钯/碳高效绿色催化Suzuki 交叉偶联反应是近年来有机合成的热点之一,如反应①: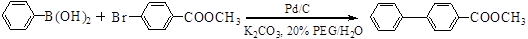
I II
化合物Ⅱ可由化合物III合成: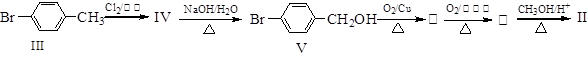
(1)化合物Ⅱ的分子式为 ,含有的官能团名称为 。
(2)化合物Ⅳ的结构简式为 。
(3)化合物Ⅵ与新制Cu(OH)2悬浊液反应的化学方程式为 (注明条件)。
(4)化合物Ⅴ的一种同分异构体Ⅷ遇FeCl3溶液显紫色,核磁共振氢谱峰面积之比为2:2:2:1,则化合物Ⅷ的结构简式为 _________ 。写出化合物Ⅷ与足量NaOH水溶液反应的化学方程式为 (注明条件)。
(5)化合物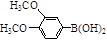 与化合物
与化合物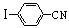 在一定条件可发生类似反应①的反应,其产物的结构简式为 。
在一定条件可发生类似反应①的反应,其产物的结构简式为 。
下图为某实验小组制取乙酸乙酯的实验装置图,烧瓶中盛有乙醇和浓H2SO4。反应时,将乙酸从分液漏斗滴入烧瓶中即可。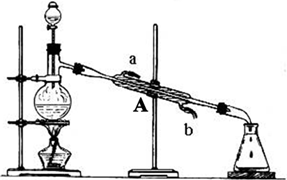
(1)为方便研究酯化反应的过程,乙醇中的氧原子用18O进行了标记(即C2H518OH),请用氧的同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式: 。
(2)装置A的名称是 ,使用时要先从 口(填“a”或“b”)进水。
(3)实验结束后,锥形瓶中收集到乙酸乙酯、乙醇和乙酸的混合液。为了将这三者进行分离,该小组依如下流程进行了进一步的实验: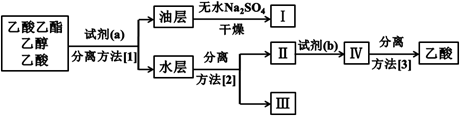
试剂(a)是 ,试剂(b)是 ,
分离方法(1)是 ,分离方法(2)是 ,分离方法(3)是 。
有A、B、C、D、E、F六种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数比C元素大11。请回答:
(1)元素 X与C、B均相邻,比较C、X元素的第一电离能Il(C) I1(x)
(2)写出F元素原子的核外电子排布式 。
(3)位于C元素上周期同主族元素的氢化物沸点最高的原因是 ,其分子中心原子的杂化方式为 ,空间构型为 。
(4)D的最高氧化物是 分子(填“极性”或“非极性”),l mol这种氧化物分子中含有 molπ键,E的最高价氧化物的晶体类型是 。
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下: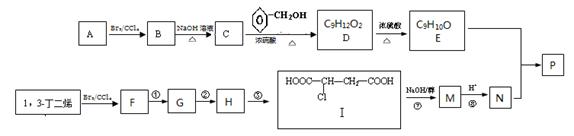
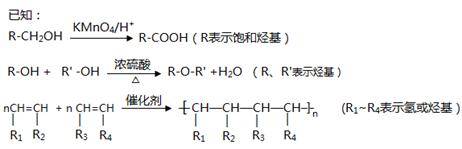
(1)A的结构式为________________,C的名称为
(2)D中含有的官能团的名称
(3)由F经①~③合成I,F可以使溴水褪色.反应①的化学方程式是 。
反应②的反应类型是 反应③的反应试剂是 。
(4)下列说法正确的是 。
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol I最多消耗3molNaOH
d.N不存在顺反异构体
(5)写出由D生成E的化学方程式 。
(6)E与N等物质的量发生共聚反应生成P,则P的结构简式为 。
(7)E有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式 。
a.苯环上有两个取代基
b.能使FeCl3液显紫色
c.1mol该有机物与浓溴水反应时能消耗4molBr2
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。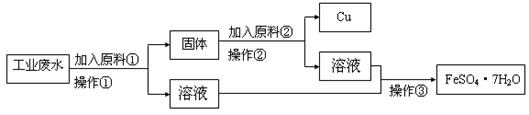
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。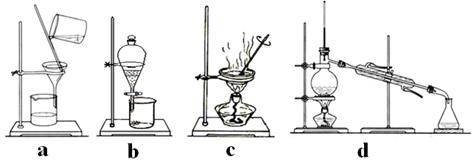
在一固定容积的密闭容器中进行如下反应: 其平衡常数K和温度,的关系如下:
其平衡常数K和温度,的关系如下:
(1)该反应的平衡常数K的表达式为___________________。
(2)该反应的正反应为__________(填“吸热”“放热”)反应。
(3)能判断该反应是否已经达到化学平衡状态的是___________。
A.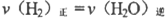 B.混合气体中CO浓度不变
B.混合气体中CO浓度不变
(4)在850℃时,可逆反应:
在该容器内各物质的浓度变化如下: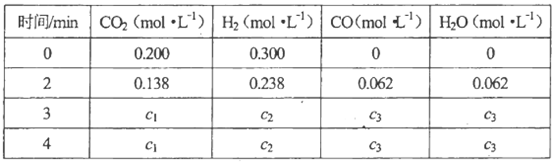
计算:3min~4min达到平衡时,CO的平衡浓度c3=________,CO2(g)的转化率a=________。