6分)实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
【资料:Na2CO3+CaCl2 =" 2NaCl" + CaCO3↓】
回答下列问题:
(1)样品加水放热的原因是 (用化学方程式表示)。
(2)②中反应的化学方程式是 。
(3)③中的实验现象是 。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是 。
依据实验现象及数据判断,原样品的成分是 。
有一固体混合物M,已知其中可能含有Ba(OH)2、Na2CO3、Na2SO4、NH4Cl、FeCl3五种物质中的两种或多种。某同学按照下图所示进行实验,出现的现象如图中所述(设过程中所有可能发生的反应都恰好完全进行)。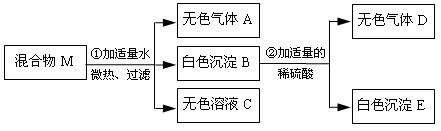
试根据实验过程和现象做出判断,填写以下空白:
(1)气体A的化学式 ;把气体D通入紫色石蕊试液中,石蕊变色。
(2)写出过程②发生反应的化学方程式。
(3)原混合物M里,还不能确定的物质是(写化学式),
要确定它是否存在,请简述你的设计方案:。
(4)农业生产中常用铵态氮肥补充土壤中的氮元素,根据实验步骤①带给你的启示,请你为使用铵态氮肥提出合理化建议:。
下图为实验室中常见的气体的制备、除杂和性质实验的部分仪器,试根据题目要求,回答下列问题: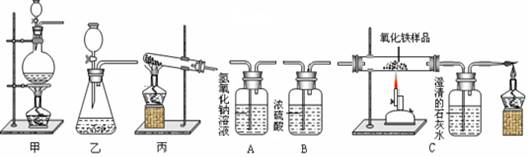
(1)请写出能用装置乙制备的一种气体的化学方程式。检查装置乙气密性的方法是 。
(2)小明同学想研究一氧化碳的还原性,通过查阅资料知道:草酸(H2C2O4)与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4加热CO↑+ CO2↑+ H2O
①用草酸制取CO,你认为应选择的发生装置是(填“甲”、“乙”或“丙”)。
②要用干燥、纯净的一氧化碳还原氧化铁并测定气体生成物的性质,合理的连接顺序是:草酸加热后的气体生成物
③能证明CO气体具有还原性的实验现象是。
④小明还想计算12g氧化铁样品中氧化铁的质量分数,他收集了以下两组数据(假设所有能发生的反应都反应完全):
数据一:根据参加反应的草酸的质量计算出制得了一氧化碳5.6g。
数据二:反应前后C装置中的盛有澄清石灰水的装置增重6.6g。
请选择合理的一组数据,计算出12g氧化铁样品中氧化铁的质量分数为(最终结果精确到0.1%)。
同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究: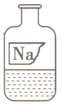
(1)小张同学取待测液测得pH=10,他得出的关于溶液成分的结论是。
(2)他取少量待测液于试管中,加入过量的稀HCl,看到,由此小张同学认为,溶液为Na2CO3溶液。
(3)小李同学对小张同学的结论提出疑问,并进行了以下实验进行验证:取少量待测液于试管中,加入过量的CaCl2溶液,生成白色沉淀,该反应方程式为,静置,(写出还需进行的操作及现象)。
通过实验,小李认为小张结论正确。
(4)二位同学给试剂瓶贴一新标签:Na2CO3。
(5)实验结束后,同学们通过讨论认为试剂瓶原标签也可能不是Na2CO3,你认为他们的理由是。
氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知,氢化钙(CaH2)与水反应生成氢氧化钙和氢气。
请写出该反应的化学方程式:
探究小组的同学把一定量的CaH2加入碳酸钠溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
【提出问题】滤液中溶质的成分是什么?
【猜想与假设】猜想一:氢氧化钠、碳酸钠、氢氧化钙
猜想二:氢氧化钠、碳酸钠
猜想三:
猜想四:氢氧化钠
经过讨论,大家一致认为猜想不合理,请用化学方程式说明原因:
【实验验证】
| 实验 |
现象 |
结论 |
| 实验一:取滤液,向其中滴入少量碳酸钠溶液 |
无明显现象 |
猜想不成立 |
| 实验二:另取滤液,向其中加入足量稀盐酸 |
猜想二成立 |
【反思与拓展】
①若向氯化铵的浓溶液中加一定量CaH2,充分反应,产生的气体是;
②登山运动员常用CaH2作为能源提供剂,与氢气相比,其优点是。
【定量分析】
探究小组的同学称取氢化钙样品的质量为10g,加入碳酸钠溶液中(假设氢化钙样品中的杂质不反应),充分反应后过滤、洗涤、烘干,得到滤渣质量为20g,试计算氢化钙样品中氢化钙的质量分数。(要求写出计算过程)
【问题情景】某化学实验小组的同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多气泡放出。这一现象激发起同学们的探究欲望:生成了什么气体?
【提出猜想】从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
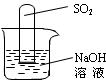
(1)甲同学认为是O2,则检验方法是。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH溶液反应的化学方程式。
(3)实验小组同学合作设计了如图组合实验方案,排除和验证猜想的气体。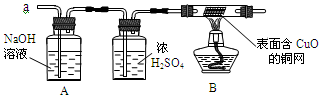
如果放出的是O2和H2,你认为方案中的安全隐患是,丙同学认为:为确保安全,实验前应先收集一试管气体,然后,若听到,方可采用上面的装置进行实验;如果听到,则不能采用上述装置。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(4)结论:铁粉与硫酸铜溶液反应时,产生的气体是。
(5)由上述实验可以推出,硫酸铜溶液中可能含有。(填物质化学式)
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了下图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是。要得到科学严谨的结论,仍利用该装置,需要补做的实验是。