以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是()
| A. |
在阴极式,发生的电极反应为:
 ↑
↑
|
| B. |
在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区
浓度增大,使平衡
+2
 +
向右移动
+
向右移动
|
| C. |
该制备过程总反应的化学方程式为:

|
| D. | 测定阳极液中 和 的含量,若 与 的物质的量之比为 ,则此时铬酸钾的转化率为 |
雷达的微波过滤器里使用铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是
| A.可表示为3YO3·3FeO·Fe2O3 | B.可表示为Y3O5·Fe3O4·Fe2O3 |
| C.其中钇、铁的化合价均为+3价 | D.其中钇、铁的化合价均有+2、+3价 |
“嫦娥一号”成功发射,标志我国已具有深太空探测能力。据科学家预测,月球的土壤中吸附着数百万吨的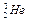 ,每百吨
,每百吨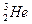 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以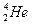 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
A.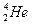 原子核内含有4个质子 原子核内含有4个质子 |
B.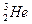 和 和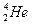 互为同位素 互为同位素 |
C.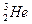 原子核内含有3个中子 原子核内含有3个中子 |
D.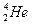 比 比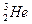 多1个电子 多1个电子 |
下述反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应: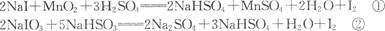
根据上述信息,手球断下列说法正确的是 ( )
| A.两个反应中NaHS04均为氧化产物 |
| B.在反应①中NaI是氧化剂,在反应②中NaI03中的碘元素被氧化 |
| C.氧化性:Mn02>SO42一>IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数之比为1:5 |
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为: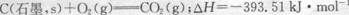
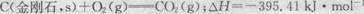
则以下说法正确的是( )
| A.在该条件下金刚石比石墨稳定,等质量时金刚石的能量大于石墨 |
| B.金刚石转化为石墨为放热反应 |
| C.石墨转化为金刚石为物理变化 |
| D.由于石墨转化为金刚石为吸热反应,因此石墨在任何条件下都不可能转化为金刚石 |
下列化学实验基本操作中正确的是 ( )
| A.分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
| B.蒸馏时,将温度计水银球置于被蒸馏的石油液面下,且不触及蒸馏烧瓶的底部 |
| C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡并平视滴定管内液面 |
| D.称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 |