甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 |
化学方程式 |
焓变 | 活化能 |
| 甲烷氧化 |
-802.6 |
125.6 |
|
| -322.0 |
172.5 |
||
| 蒸汽重整 |
206.2 |
240.1 |
|
| 165.0 |
243.9 |
回答下列问题:
(1)反应的=kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=;
CO(g)+3H2(g)的KP=;
随着温度的升高,该平衡常数(填"增大"、"减小"或"不变")。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于。
(5)在某一给定进料比的情况下,温度、压强对和物质的量分数的影响如下图:
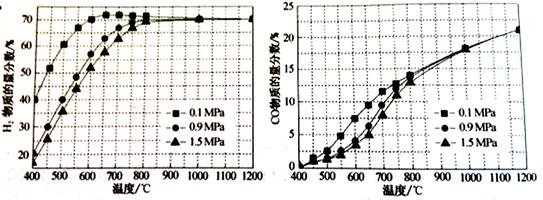
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是。
A.600℃,0.9Mpa B. C. D.
②画出条件下,系统中物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
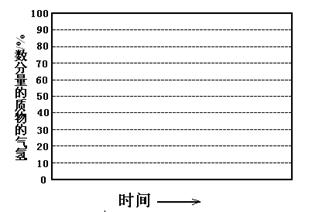
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解的化学方程式为H2C2O4 CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑ + CO2↑ + H2O。某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为。
②装置A的作用是。装置B的作用是。
③根据以上数据能否测定出锈铁的组成?答:(填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x =;m(Fe)︰m (Fe2O3·xH2O) =。
下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
(1)下列叙述中正确的是(填序号)。
| A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。 |
| B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。 |
| C.硝酸的浓度越大,还原产物中N元素低化合价产物越少。 |
| D.当硝酸密度大于1.3 g·cm-3时,还原产物主要为NO、NO2 |
(2)当硝酸溶液的密度为1.36 g·cm-3时,Fe与过量硝酸反应的化学方程式是_________________。
(3)限用下列仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(不考虑N2O4)。设计一个合理而简单的实验方案(仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略)。
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择(填装置序号),理由是。
②装置的连接顺序是(填各装置接口的序号):[ ]→[ ] [ ]→[8] [9]→[ ]。
③检查装置气密性后,开始反应。待E中充满红棕色气体,停止实验。
第2步:验证E中有NO。
④取下试管E,倒立在F中,轻轻摇动试管。
确认生成的气体中有NO的现象是。
(4)某工厂生产硝酸的流程简要表示如下:
①氧化炉中反应的化学方程式为_____________________________________________________。
②工业上通常用质量分数为15%的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,它的物质的量浓度为_____________ mol·L-1(保留2位小数)。
硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是。
(2)操作Ⅰ是。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因。
(4)加入Sn粉的作用有两个:①调节溶液pH②。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、,溶液中含量最多的三种微粒的物质的量浓度的大小关系为;
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有: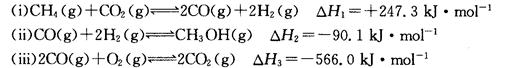
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K=,CH4的转化率为。
,则此温度下该反应的平衡常数K=,CH4的转化率为。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: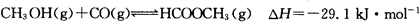 ,科研人员对该反应进行了研究,部分研究结果如下:
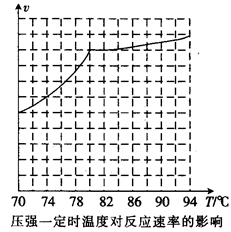
,科研人员对该反应进行了研究,部分研究结果如下: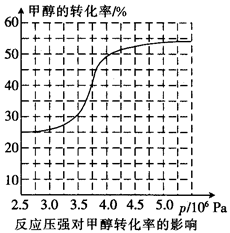
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是(填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
②实际工业生产中采用的温度是80℃,其理由是。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示: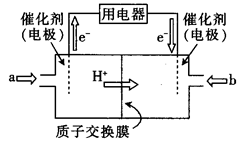
①通入a气体的电极是电池的(填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为(忽略溶液的体积变化)。