硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡, Sn相对原子质量为119
回答下列问题:
(1)锡原子的核电荷数为50,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(4)加入Sn粉的作用有两个:①调节溶液pH ② 。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0ml。锡粉中锡的质量分数是 。
(14分)2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是
造成空气污染的原因之一。
(l)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)△H <0
2CO2(g)+ N2(g)△H <0
①该反应平衡常数表达式____________________________
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol①
2NO2(g) N2O4(g)△H=-56.9 kJ/mol②
N2O4(g)△H=-56.9 kJ/mol②
H2O(g)=H2O(l)△H=-44.0 kJ/mol③
写出CH4催化还原N2O4(g)生成N2和H2O(1)的热化学方程式:_____________________。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mLlmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).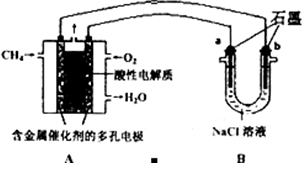
①甲烷燃料电池的负极反应式:______________________________________.
②电解后溶液的pH=____(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是________L
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题: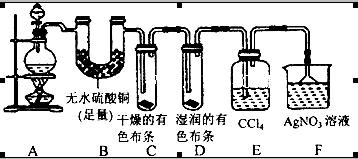
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热;②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合;④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热;⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
聚酰胺-66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可列用下列路线合成:
已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为(写一种)___________
(2)D的结构简式为_________,①的反应类型为__________
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及__________
(4)由F和G生成H的反应方程式为___________
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
活性氧化锌用途非常广泛。以氧化锌粗品(含铁的氧化物、CuO和SiO2等杂质)为原料制备活性氧化锌并生产其它副产品的生产工艺流程如下:
已知:Zn(OH)2可溶于NaOH溶液。
请回答下列问题:
(1)“溶解”前将氧化锌粗品粉碎成细颗粒,其目的是。
(2)操作A所得滤渣的主要成分是。
(3)加入过量Fe时,滤液M中与Fe反应的离子有。
(4) 操作C所得的滤渣P中含有Fe(OH)2和Fe(OH)3,请写出生成Fe(OH)3的化学反应方程式为。
(5)“沉淀”的成分为ZnCO3·2Zn(OH)2·H2O,可用氧化物的形式把它改写为。