实验室制备苯乙酮的化学方程式为:
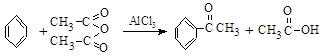
制备过程中还有 ↑等副反应。
↑等副反应。
主要实验装置和步骤如下:
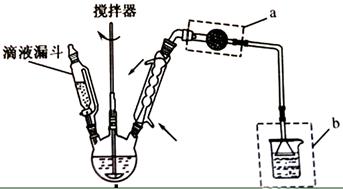
(I)合成:在三颈瓶中加入20 无水和30无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6乙酸酐和10无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器的名称:;装置的作用:。
(2)合成过程中要求无水操作,理由是。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致。
| A. | 反应太剧烈 | B. | 液体太多搅不动 | C. | 反应变缓慢 | D. | 副产物增多 |
(4)分离和提纯操作②的目的是。该操作中是否可改用乙醇萃取?(填"是"或"否"),原因是_。
(5)分液漏斗使用前须洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并后,将分液漏斗置于铁架台的铁卷上静置片刻,分层。分离上下层液体时,应先,然后打开活塞放出下层液体,上层液体从上口倒出。
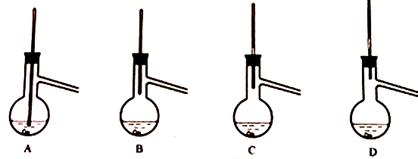
(6)粗产品蒸馏提纯时,下来装置中温度计位置正确的是_,可能会导致收集到的产品中混有低沸点杂质的装置是_。
(14分)某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)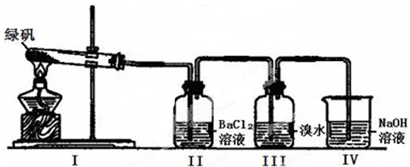
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为__________,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。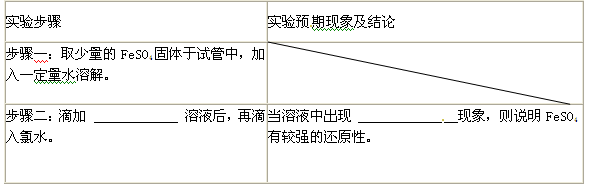
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________。
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置,请回答下列问题: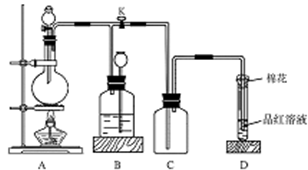
Ⅰ.(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为:__________________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是 ,其作用是___________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是 (填写字母代号)
a.水b.浓溴水
c.KMnO4酸性溶液d.NaHSO3饱和溶液
Ⅱ.为了验证木炭和浓H2SO4反应生成了SO2和CO2,有人设计了以下实验。
(提示:酸性高猛酸钾溶液可把SO2氧化成H2SO4, 试剂可以重复使用)
(4)各装置中盛放的试剂是(填序号):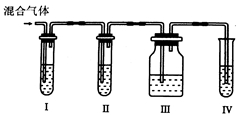
Ⅰ_______ Ⅱ_______ Ⅲ_______ Ⅳ_______
| A.品红溶液 | B.NaOH溶液 | C.澄清石灰水 | D.高锰酸钾溶液 |
(5)能说明SO2存在的现象是________________________________________。
(6)使用装置Ⅱ的目的是___________________________________________。
(7)使用装置Ⅲ的目的是 。
(8)确认含有CO2的现象是 。
某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中试管内盛放的物质是Ca(OH)2、NH4Cl固体。
【实验探究】
(1)A中发生反应的化学方程式为 。
(2)B中盛放的干燥剂为 ,干燥氨气能否用浓硫酸 (填“能”或“不能”)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L
(4)实验室收集氨气的方法是 。
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”),红色石蕊试纸变成 色。
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。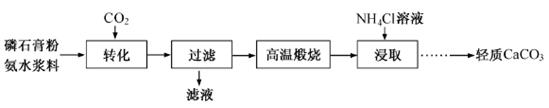
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见下图。清液pH>11时CaSO4转化的离子方程式____________;能提高其转化速率的措施有____(填序号)
| A.搅拌浆料 | B.加热浆料至100℃ |
| C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有__________。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
a.水b.碱石灰C.浓硫酸d.饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸:
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气中ClO2的质量为 g。
(4)用ClO2处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是_______(填标号)。
a.明矾b.碘化钾c.盐酸d.硫酸亚铁