化学小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置,分层。
就此实验,完成下列填空:
⑴正确操作步骤的顺序是:(用上述各操作的编号字母填写)
→ → →A→G→ →E→F
⑵上述E步骤的操作中应注意 。
上述G步骤操作的目的 。
⑶能选用CCl4从碘水中萃取碘的原因是
下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。
(1) E处是一种纯净物,其发生反应的化学方程式为___ _____。
(2)为使A中乙醇平稳汽化成乙醇蒸气,常采用的方法是_______ ______。
D处使用碱石灰的作用是__ _____。
(3)能证明乙醇反应后产物的实验现象是
。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同。推断B处发生反应的化学方程式____。
用图示装置制取少量乙酸乙酯(酒精灯、铁架台等在图中均已略去),请填空: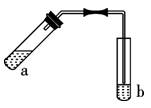
(1)写出试管a中发生反应的化学方程式
(2)某同学在实验过程中,试管a中忘记加入碎瓷片就加热进行实验,为防止暴沸,下一步的操作是:。
(3)实验中加热试管a的目的是:
①:
②:
(4)反应结束后,振荡试管b静置,观察到的现象是
。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: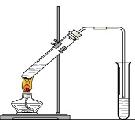
⑴写出制取乙酸乙酯的化学反应方程式
⑵浓硫酸的作用是:①;②
⑶饱和碳酸钠溶液的主要作用是
⑷装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,
目的是防止 。
⑸若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
为定性探究乙醇的性质,某化学课外小组通过查阅资料并设计了实验方案进行探究。
方案Ⅰ:在盛有少量无水乙醇的试管中,加入一粒除去煤油的金属钠,在试管口迅速塞上配有尖嘴导管的单孔塞,点燃放出的气体,并把一干燥的小烧杯罩在火焰上,在烧杯壁上出现液滴后,迅速倒转烧杯,向烧杯中加入少量的澄清石灰水,观察有无混浊产生。
(1)请写出乙醇与钠反应的化学方程式: ▲。
(2)以上实验设计因缺少必要的步骤而存在安全隐患,请你指出所缺少必要的步骤是
▲。
(3)若向烧杯中加入少量澄清石灰水后发现有混浊,则燃烧产生CO2的物质最可能是
▲ (写名称)。
方案Ⅱ:(1)取一根铜丝,把其中一端绕成螺旋状(增大接触面积)。点燃一盏酒精灯,把绕成螺旋状一端的铜丝移到酒精灯外焰上灼烧(如右图1),观察到的实验现象: ▲。
(2)把螺旋状铜丝往酒精灯内焰移动,观察到的实验现象: ▲,用化学方程式表示该现象产生的原理: ▲。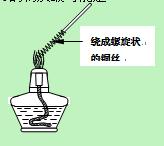
镁能在二氧化碳中燃烧:2Mg+CO22MgO+C,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如下装置进行探究。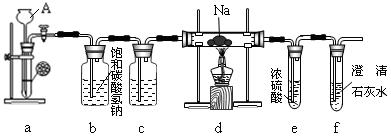
请回答下列问题:
(1)装置a的作用是,仪器A的名称。
(2)装置b的作用是,装置c中应盛放。
(3)实验过程中,在点燃d装置中的酒精灯前,必须经过必要的操作方可进行后续的实验,该必要的操作是。
(4)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解于水,黑色物质不溶。过滤,得到澄清的滤液。将滤纸上的黑色物质移入小试管中,加少量浓硫酸,加热有刺激性气味的气体生成。则该黑色物质与浓硫酸共热的化学反应方程式为。
(5)往(4)所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式:。