化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与共热制取并进行相关实验。
①下列收集的正确装置是。

②将通入水中,所得溶液中具有氧化性的含氯粒子是。
③设计实验比较和的氧化性,操作与现象是:取少量新制氯水和于试管中,。
(2)能量之间可以相互转化:电解食盐水制备是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:,,;铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图,并作相应标注。

要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极。
③甲乙两种原电池中可更有效地将化学能转化为电能的是,其原因是。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选作阳极。
为验证卤素单质氧化性的相对强弱,某小组同学用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。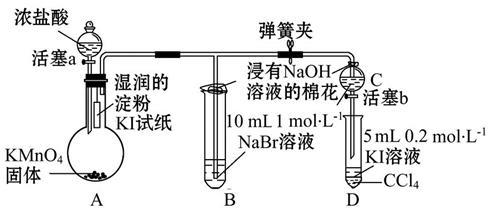
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)氯、溴、碘单质的氧化性逐渐减弱的原因:从原子结构分析,同主族元素从上到下 ,得电子能力逐渐减弱。
(5)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是___________ ___。
实验室以苯、乙醛为原料,AlCl3为催化剂制备1,1–二苯乙烷,其反应原理为:
已知:AlCl3固体遇水会发生较强烈水解。
I.制取装置如右图所示。
(1)该反应需控制反应温度为20℃。控制20℃的方法是 ;该反应不高于20℃的可能原因是: 。
(2)仪器a的作用是 ;装置c的作用是吸收HCl,写出产生HCl的化学方程式 ;装置b的作用是 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到1,1–二苯乙烷。
(1)分液漏斗中,产品在 (填“上”或“下”)层;洗涤操作中,第二次水洗的目的是 ;无水硫酸镁也可用物质 代替。
(2)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是 (选填编号)。
(3)三口烧瓶中加入120mL苯(密度0.88g/mL)、19g A1C13和3.7g乙醛,20℃时充分反应,制得纯净的1,1–二苯乙烷7.8g。该实验的产率约为 。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu元素的相对原子质量,同时检验氯气的氧化性。
(1)为完成上述实验,正确的连接顺序为A连 ;B连 (填写连接的字母)。
(2)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为 。
(3)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是 ,对应的现象为 。
(4)丙装置的c瓶中盛放的试剂为 ,作用是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案,精确测量硬质玻璃管的质量为a g, 放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g ,充分反应完全后。
甲方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
乙方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g, 进而确定Cu的相对原子质量。
①请你分析并回答: 方案测得结果更准确。你认为不合理的方案的不足之处在 。
②按测得结果更准确的方案进行计算,Cu的相对原子质量是 。
右图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度是________ 。
。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要250 mL 4.6  的稀硫酸,则需要取______mL的该硫酸。将上述硫酸进行稀释的实验
的稀硫酸,则需要取______mL的该硫酸。将上述硫酸进行稀释的实验
操作是 。
(3)在配制过程中,所要用到的仪器主要有量筒、玻璃棒及 。
(4)在配制4.6  的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
的稀硫酸的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”、“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中________;
②容量瓶用1  稀硫酸润洗________;
稀硫酸润洗________;
③定容时仰视观察液面________。
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6  盐酸、6
盐酸、6  硫酸和蒸馏水)
硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是___________________,装置E中碱石灰的作用是 。
(3)装置D中发生反应的化学方程式是:___________________、 。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。