下列图示与对应的叙述相符的是
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的ΔH>0 2AB3(g)的ΔH>0 |
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大 3C(g)+D(g)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图④,若除去0.1mol·L-1CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
下列反应的离子方程式正确的是( )
A.NH4HCO3溶液与过量KOH浓溶液共热:   |
B.用双氧水和稀硫酸处理印刷电路板: |
C.用FeS除去工业废水中的 |
D.足量的 通人Ca(ClO)2溶液中:Ca2++2C1O 通人Ca(ClO)2溶液中:Ca2++2C1O +SO2=====CaSO4↓+2C1 +SO2=====CaSO4↓+2C1 |
现将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则过剩的锌粉的质量为()
| A.1.0g | B.2.0g | C.2.5g | D.3.5g |
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解l9.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示。下列分析或结果错误的是()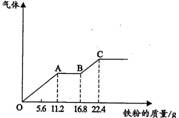
A.原混合酸中NO 物质的量为0.2mol 物质的量为0.2mol |
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+====3Fe2+,BC段产生氢气 | C.第二份溶液中最终溶质为FeSO4 | D.H2SO4浓度为2.5mol·L-1 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是 ( )
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
| A.K3C60中只有离子键 | B.K3C60中不含共价键 |
| C.该晶体在熔融状态下能导电 | D.C60与12C互为同素异形体 |