某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 | B.Cl-一定存在,且c(Cl‑)≥0.4 mol/L |
| C.SO42-、NH4+一定存在,Cl-可能不存在 | D.CO32-、Al3+一定不存在,K+可能存在 |
能与KOH的醇溶液发生消去反应的是
| A.(CH3CH2)3CCH2Cl | B.CH3Cl |
C.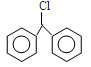 |
D.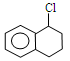  |
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是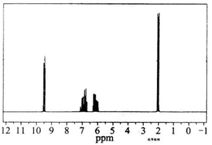
| A.分子中共有5种化学环境不同的氢原子 |
| B.该有机物的结构简式为CH3CH=CHCOOH |
| C.该物质的分子式为C4H6O |
| D.该有机物不可能与氢气反应 |
由C、H、O组成的化合物8.80 mg,完全燃烧后得二氧化碳22.0 mg,水10.8 mg.该化合物的实验式是
A.C5H6OB.C5H12C.C5H12O2D.C5H12O
下列实验中,为实现实验目的而必须除杂的是
| 实验 |
除杂试剂 |
实验目的 |
|
| ① |
电石与水反应 |
CuSO4溶液 |
用KMnO4酸性溶液检验乙炔的还原性 |
| ② |
CH3CH2Br与NaOH溶液共热 |
HNO3溶液 |
用AgNO3溶液检验CH3CH2Br中的Br |
| ③ |
淀粉与稀H2SO4水浴共热 |
NaOH溶液 |
用新制氢氧化铜检验水解产物的还原性 |
| ④ |
C2H5OH与浓H2SO4加热至170℃ |
NaOH溶液 |
用Br2的CCl4溶液证明该反应为消去反应 |
A.只有①②③B.只有①②④ C.只有②③④ D.①②③④
实验室制备苯甲醇和苯甲酸的化学原理是 ,
,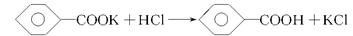
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3 ℃,苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示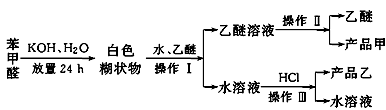
试根据上述信息,判断以下说法错误的是
| A.操作Ⅰ是萃取分液 |
| B.乙醚溶液中所溶解的主要成分是苯甲醇 |
| C.操作Ⅱ蒸馏所得产品甲是苯甲醇 |
| D.操作Ⅲ过滤得到产品乙是苯甲酸钾 |