由C、H、O组成的化合物8.80 mg,完全燃烧后得二氧化碳22.0 mg,水10.8 mg.该化合物的实验式是
A.C5H6O B.C5H12 C.C5H12O2 D.C5H12O
某元素原子的价电子构型为2s22p5的元素,与其同周期元素相比,下列有关描述中正确的有
| A.原子序数为7 | B.电负性最大 |
| C.原子半径最大 | D.第一电离能最大 |
下列电子排布式中属于基态原子的是
| A.1S22S12P1 | B.1S22S22P63S23P63d1 |
| C.1S22S22P63S23P63d54S1 | D.1S22S22P63S23P63d64S1 |
下列描述中不符合生产实际的是
| A.电解水制氢气和氧气时,用铜作阳极 |
| B.电解法精炼粗铜时,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱时,用涂镍碳钢网作阴极 |
| D.在镀件上电镀铜时,用铜作阳极 |
下列有机物命名正确的是
| A.2,4,5—三甲基—5—乙基辛烷 | B.2,5—二甲基—4—乙基己烷 |
| C.3—甲基—4—乙基戊烷 | D.2,3—二甲基—4 —戊烯 —戊烯 |
由1—溴丁烷制取少量的1,2—丁二醇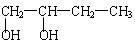 时,需要经过下列哪几步反应
时,需要经过下列哪几步反应
| A.取代、消去、加成 | B.加成、消去、取代 |
| C.消去、加成、取代 | D.消去、加成、消去 |