海洋是一座巨大的宝藏,海水中蕴含80多种元素。氯碱工业和制备金属镁的原料都可来自于海水。
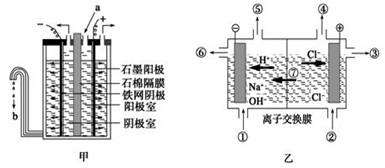
Ⅰ.在氯碱工业中,曾用石棉隔膜电解槽来电解食盐水(如图甲所示)。
(1)写出阳极的反应式 。
(2)图甲中流出的b是 溶液。
(3)石棉隔膜的作用是 。
Ⅱ.随着科技的发展,电解工艺不断革新,电解效率和产品纯度得到提高。20世纪80年代起,隔膜法电解工艺逐渐被离子交换膜电解技术取代。
(1)离子交换膜电解槽(如图乙所示)中⑥、⑦分别是_______、______________。
(2)已知一个电子的电量是1.602×10-19C,用离子膜电解槽电解饱和食盐水,当电路中通过1.929×105 C的电量时,生成NaOH_ g。
Ⅲ.下图是工业上生产镁的流程。

(1)写出下列反应的化学方程式:
①沉淀池: ; ②电解: ;
(2)整个生产流程中循环使用的物质是 。
(3)简述加热氯化镁的结晶水合物使之脱水转化为无水氯化镁的注意事项: 。
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)△H1=+206.0kJ/mol
CO(g)+3H2(g)△H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g)△H2
CH3OH(g)△H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。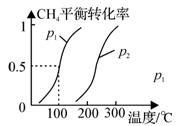
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2) =。
②图中p1p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图所示。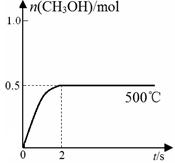
①应(ii)需在(填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,
原因是(用化学方程式表示)。
③在500℃恒压条件下,请在上图中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g) 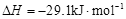 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: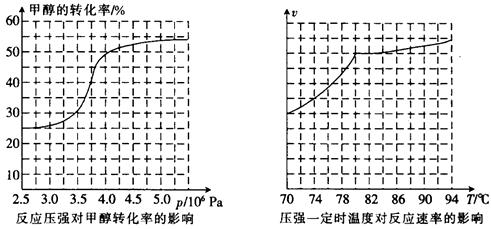
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是。 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是。
(15 分)二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g) +CO(g)  CH3OH(g) ΔH=" —90.0" kJ· mol-1 ①
CH3OH(g) ΔH=" —90.0" kJ· mol-1 ①
2CH3OH(g)  CH3OCH3(g) + H2O(g) ΔH="—24.5" kJ· mol-1 ②
CH3OCH3(g) + H2O(g) ΔH="—24.5" kJ· mol-1 ②
CO(g) + H2O(g) CO2(g) + H2(g) ΔH="—41.1" kJ· mol -1③
CO2(g) + H2(g) ΔH="—41.1" kJ· mol -1③
(1)反应①的 ΔS 0(填“>”、“<”或“=”)。在(填“较高”或“较低”)温度下该反应自发进行。
(2)在 250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是_______(填选项字母)
| A.容器内气体密度保持不变 |
| B.CO 与 CO2的物质的量之比保持不变 |
| C.H2O 与 CO2的生成速率之比为 1∶1 |
| D.该反应的平衡常数保持不变 |
(3)已知一些共价键的键能如下:
运用反应①计算一氧化碳中碳氧共价键的键能kJ· mol-1。
(4)当合成气中 CO 与 H2的物质的量之比恒定时,温度、压强对 CO 转化率的影响如图 1 所示。图 1 中 A 点的 v(逆)B 点的 v(正)(填“>”、“<”或“=”),说明理由。实际工业生产中该合成反应的条件为 500℃、4MPa 请回答采用 500℃的可能原因。
(5)一定温度下,密闭容器中发生反应③,水蒸气的转化率与 n(H2O)∕n(CO)的关系如图2所示。计算该温度下反应③的平衡常数 K=。
在图 2 中作出一氧化碳的转化率与 n(H2O)∕n(CO)的曲线。
[化学—选修2:化学与技术]化学镀是指使用合适的还原剂,使镀液中的金属离子还原成金属而沉积在镀件表面上的一种镀覆工艺。化学镀广泛用作金属、塑料、玻璃、陶瓷等许多材料的装饰和防护。在ABS工程塑料表面进行化学镀镍的流程如下:
回答下列问题:
(1)化学镀与电镀比较,优点之一是_________。
(2)镀件表面用热碱液清洗的作用是_________,镀件表面粗化的目的是增强亲水性及_________。
(3)镀件浸入AgNO3溶液后,镀件表面吸附的SnCl2将AgNO3还原生成有催化活性的金属银,反应的化学方程式是_________。
(4)镀镍时,镀液中的Ni2+与H2PO2-在催化表面上反应沉积镍,同时生成中强酸H3PO3及与金属镍物质的量相等的氢气,该反应的离子方程式是_________。
(5)化学镀某种金属时,反应时间与镀层厚度的实验数据记录如下表所示:
由此推断,镀层厚度y与反应时间t的关系式为_________;欲使镀层厚度为6anm,需要的反应时间为_________。
(6)化学镀镍废液中含有Ni2+等污染物,需转化为沉淀除去。已知25℃,Ksp[Ni(OH)2]=2.0×10-15。若加入碱后使废液的pH=10,则处理后的废液中镍元素的含量为_________mg·L-1。
硫酰氯(SO2Cl2)是重要的化学试剂,可由如下反应制取:SO2(g)+Cl2(g) SO2Cl2(g)△H
SO2Cl2(g)△H
针对该反应回答下列问题:
(1)已知:①SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)△H1=-akJ/mol
2SOCl2(g)△H1=-akJ/mol
②SO2Cl2(g)+SCl2(g) 2SOCl2(g)△H2=-bkJ/mol(a>b>0)
2SOCl2(g)△H2=-bkJ/mol(a>b>0)
则△H=________kJ/mol(用a、b的代数式表示)
(2)为了提高该反应中Cl2的平衡转化率,下列措施合理的是________(填字母序号)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)若在绝热、恒容的密闭体系中,投入一定量SO2和Cl2,发生该反应,下列示意图能说明t1 时刻反应达到平衡状态的是(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)若在催化剂作用下,将n molSO2与nmolCl2充入容积可变的密闭容器中,并始终保持温度为T,压强为P。起始时气体总体积为10L,t min时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则υ(SO2)= _________。
②此温度下,该反应的K=_________。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是_________。
(5)该反应的产物SO2Cl2遇水发生剧烈水解生成两种强酸,写出其化学方程式_______________;已知 于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______。
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+ Cu2S=6Cu+SO2
该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠( 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。
②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.