固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。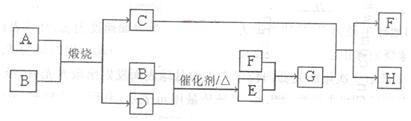
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则: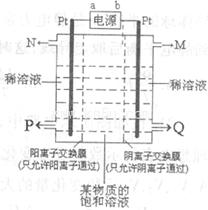
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
硝酸铝是重要的化工原料。
(1)在实验室中,硝酸铝必须与可燃物分开存放,是因为硝酸铝具有。
A.可燃性 B.氧化性 C.还原性
(2)用Al作电极电解HNO3溶液制取Al(NO3)3,电解反应的离子方程式为。
(3)查资料得知:当Al(NO3)3溶液pH>3时,铝元素有多种存在形态,如Al3+、[Al(OH)]2+、[Al(OH)2]+等。写出[Al(OH)]2+转化为[Al(OH)2]+的离子方程式。
(4)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
①(CH2)6N4水溶液显碱性。请补充完整下列离子方程式。
②经搅拌Ⅱ,pH下降的原因是。
③凝胶中含有的硝酸盐是。
(Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在)
④煅烧过程主要发生如下转化:  。
。
煅烧过程中样品的失重率(TG%)随温度变化如图。凝胶煅烧失重曲线有明显的三个阶段:
(i)a~b段:失重率82.12%;
(ii)b~c段:失重率9.37%;
(iii)c~d段:失重率几乎为0;
转化Ⅱ对应的失重阶段是(填序号),转化Ⅲ开始的温度是。
(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A)c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是(用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)
请仔细观察下列三种装置的构造示意图。根据要求回答问题:
(1)电解精炼铜(如图1)时,b极材料是________(填“纯铜”或“粗铜”);其电解质溶液能否用CuCl2替代?答:________(“能”或“否”)。
(2)碱性锌锰电池(如图2)的总反应式为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,该电池的负极反应式为______________________。若有0.65g锌参与了电池反应,则转移电子的物质的量为mol。
(3)铅-硫酸蓄电池(如图3)放电过程中,负极的电极反应式为,充电时,Pb电极应接电源的______极(填“正极”或“负极”)。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下: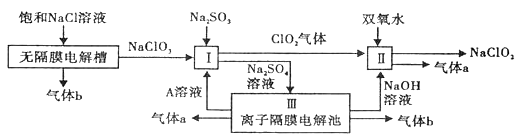
(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2b.FeCl2c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07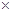 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是