(1)下列四种粒子中,半径按由大到小的排列顺序是 。
①基态X的原子结构示意图:○+16
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图: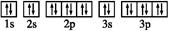
④W基态原子有2个能层,电子式:∶∶
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 ,离子半径由大到小的顺序是 ,原子序数由大到小的顺序是 。
工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(1)此反应的平衡常数表达式K=。升高温度,K值(填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题:
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是(填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。现有一包铁粉和铜粉的混合粉末17.6 g,使其完全溶解恰好需要200 mL 3.0 mol/L的FeCl3溶液。假设溶液反应前后体积不变,试计算:
(注意:无计算过程不给分)
(1)混合粉末中铜的质量;
(2)反应后溶液中FeCl2的物质的量浓度;
(3)常温下,该混合粉末与足量浓硝酸反应,最多可生成气体的体积。(25℃、101 kPa时,该气体的摩尔体积为24.5 L/mol)
计算:
(1)2mol Na2CO3的质量是g。
(2)标准状况下11.2 L N2所含分子数是个。
(3)将80gNaOH溶于水形成1L溶液,所得溶液中NaOH的物质的量浓度 mol/L。
(4)现有100 ml 1.00 mol/L NaCl溶液,所含NaCl固体的质量是g。
(本题共14分)元素周期表中大多数元素是金属元素,金属及其化合物在生活生产中有着重要应用,根据试题信息,完成下列计算:
51.某常见二价金属12.6g与足量稀硫酸反应,生成氢气5.04L(S.T.P),该元素原子的摩尔质量为g/mol。
52.39.32g某金属混合物,由12.32g镁和0.25mol另一种比镁不活泼的金属元素A组成,该混合物与一定量盐酸反应,产生氢气4.928L(S.T.P),则参加反应的HCl为mol,金属A的相对原子质量为。
53.由NaCl、NaHCO3、Na2CO3·10H2O组成的混合物157.8g,充分加热后,产生的气体(气体温度150℃)依次通过无水CaCl2和碱石灰,两种吸收剂分别增重59.4g和13.2g,则混合物中NaHCO3的质量分数为,若等质量的该混合物与足量盐酸反应,产生二氧化碳(S.T.P)L。
54.将一包铝热剂(铝粉和氧化铁的混合物)进行如下实验
①向一份铝热剂中加入800mL 2.0mol/L的NaOH溶液,使其充分反应后,收集到的气体体积为20.16L(S.T.P)。
②另一份等质量的铝热剂在高温下充分反应后,向反应后固体中加入2L 2.5mol/L的盐酸溶液,使固体完全溶解,反应后溶液pH=0(假设过程中溶液体积不变),取少量反应后溶液,滴加硫氰化钾,没有出现血红色。完成下列计算:
(1)计算该铝热剂中铝与氧化铁物质的量之比。
(2)实验②产生的气体体积是多少(S.T.P)?
(本题共14分)
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为(精确到0.001)。
往滤液中通入CO2,发生的反应为: 2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O,若生成0.5 mol Na2CO3,则生成Al(OH)3mol。
52.有反应Al2O3(s)+ Na2CO3(s) 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| Al2O3 |
Fe2O3 |
Na2O |
|
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:得到的赤泥t(精确到0.001,下同);可制得Al2O3得t;需要补充购买Na2CO3kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a=;
求b的值(精确到0.001):