(本题共14分)
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为: 2NaAl(OH)4 + CO2→2Al(OH)3↓+Na2CO3+ H2O,若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.有反应Al2O3(s)+ Na2CO3(s) 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
| |
Al2O3 |
Fe2O3 |
Na2O |
| 质量分数 |
0.065 |
0.850 |
0.029 |
每1t铝土精矿生产时:得到的赤泥 t(精确到0.001,下同);可制得Al2O3得 t;需要补充购买Na2CO3 kg。
53.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;
求b的值(精确到0.001):
在一密闭的2L容器里装有2molN2和6molH2 ,在一定条件下开始反应, 2min末测得容器中有1.2mol H2 ,请计算2min末NH3的浓度。
用铜和浓硫酸反应,得到SO2的体积为2.24L(标准状况)。
(1)试计算被还原的硫酸的物质的量。
(2)将得到的CuSO4溶液加水配成500ml溶液,则500mlCuSO4溶液中CuSO4的的物质的量浓度是多少?
充分燃烧某糖,消耗的O2、生成的CO2和H2O的物质的量都相等,它的相对分子质量是它实验式式量的6倍,0.1 mol 该糖能还原银氨溶液生成21.6 g银,0.1 mol该糖能与30 g乙酸发生酯化反应。求该糖的:
(1)实验式。
(2)相对分子质量、分子式。
(3)若该糖是直链分子,已知同一个碳原子上连有2个—OH不稳定,试推导其结构简式。
一定质量的某金属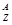 X和足量的稀H2SO4反应,生成6.02×1022个
X和足量的稀H2SO4反应,生成6.02×1022个 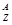 Xn+ ,这些阳离子共有6.02×1.3×1023个质子、6.02×1.4×1023个中子。
Xn+ ,这些阳离子共有6.02×1.3×1023个质子、6.02×1.4×1023个中子。
(1)求Z、n和A的值。
(2)写出该金属与稀H2SO4反应的化学方程式。
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅、铁、铝等配制而成。试回答:
(1)30Si的原子的中子数为________。
(2)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则n=________。
(3)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(4)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。(只写结果)