下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是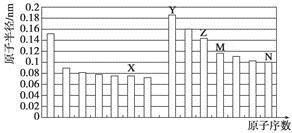
| A.Z、N两种元素的离子半径相比,前者较大 |
| B.X、N两种元素的气态氢化物的沸点相比,前者较低 |
| C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
将4 mol A 气体和2 mol B 气体在2 L的容器中混合并在一定条件下发生反应2A(g)+B(g) 2C(g)。若经2 s后达到平衡,测得C 的浓度为0.6 mol·L-1。则下列说法正确的是()
2C(g)。若经2 s后达到平衡,测得C 的浓度为0.6 mol·L-1。则下列说法正确的是()
| A.用物质A 表示的反应的平均速率为0.6 mol·L-1·s-1 |
| B.用物质B 表示的反应的平均速率为0.3 mol·L-1·s-1 |
| C.2 s 时物质A 的转化率为70% |
| D.2 s 时物质B 的浓度为0.7 mol·L-1 |
在氢氧化钠中不存在的化学键是()
| A.离子键 | B.共价键 | C.非极性键 | D.极性键 |
工业制氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
为除去溶液中的Fe2+,可以采用的方法是( )
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.通入适量Cl2,再加碱调整溶液的pH为4 |
| D.直接加铁粉将Cu2+还原出来 |
已知Ksp(AB2)=4.2×10-8,Ksp(AC)=3.0×10-15。在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3 mol·L-1,则溶液中c(C-)为( )
A.1.8×10-13 mol·L-1 B.7.3×10-13 mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1
向饱和的BaSO4溶液中加水,下列叙述正确的是( )
| A.BaSO4溶解度增大,Ksp不变 |
| B.BaSO4溶解度、Ksp增大 |
| C.BaSO4溶解度不变,Ksp增大 |
| D.BaSO4溶解度、Ksp均不变 |