A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为40,B、W同周期,D、E同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素的盐酸盐或硫酸盐可以用来净水,原理是_______________________(文字表述)。
(2)A2W2的分子中所含的化学键为________、________,经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式____________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃,DA能与水反应放氢气,若将1 mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是__________________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1∶2,且无气体生成,则该反应的离子方程式为____________________。
(6)在常温下用气体密度测定BW2的相对分子质量,实验值比理论值偏________(填 “高”或“低”),其原因是___________________。
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是(填物质的化学式)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时)、。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是。
| A.Au | B.Cu | C.Al | D.Fe |
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①,②Na2CO3,③,④NaHCO3。
已知某物质X能发生如下转化: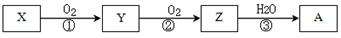
下列有关上述转化关系中物质及其反应的叙述错误的是
| A.若X为N2或NH3(催化氧化),则A为硝酸 |
| B.若X为S 或H2S(完全燃烧),则A为硫酸 |
| C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应 |
将4molA气体和2molB气体在2L的密闭容器中混合,在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)若经过2秒后测得C的浓度为0.6mol/L。
2C(g)若经过2秒后测得C的浓度为0.6mol/L。
则:(1)2s内用B表示的反应速率。
(2)2s时A的物质的量浓度为。
(3)2s时B的物质的量为。
(4)最终C的浓度 (填“能”或“不能”)达到2mol/L。
下图表示由短周期元素组成的一些物质之间的转化关系(某些反应产物已略去)。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。
⑴ 物质F的化学式。
⑵ 物质B的电子式。
⑶ 写出C→E的化学方程式。
⑷ 写出G→E的离子方程式。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是(填名称) ,W在周期表中的位置。
(2)X与Y 形成化合物的电子式为,X与W组成的化合物中存在键(填“离子”“共价”)。
(3)①写出实验室制备YX3的化学方程式:。
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2molYX3气体时放出
92.4kJ的热量,写出该反应的热化学方程式。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是。