下列有关实验现象的预测或装置的选用正确的是
| A.用装置(Ⅰ)加热草酸晶体获取某些气体(草酸晶体的熔点101.5 ℃,分解温度约为150 ℃) |
| B.用装置(Ⅱ)进行实验时,酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C.用装置(Ⅲ)进行实验时,广口瓶内先有浅红棕色气体出现后又变为无色,且不会产生空气污染 |
| D.用装置(Ⅳ)分离溴苯和苯的混合物 |
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的( )
| A.肯定有A13+、Mg2+、NH4+、Cl— | B.肯定有Al3+、Mg2+、HCO3— |
| C.肯定有K+、HCO3—、MnO4— | D.肯定有A13+、Mg2+、SO42— |
将a L SO 气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是( )
气体通过灼热的装有催化剂(V2O5)的硬质玻璃管,反应后测得气体体积增大了b L(气体体积均在同温同压下测定),则下列叙述正确的是( )
A.SO 的转化率为 的转化率为 |
B.混合气体的平均相对分子质量为 |
C.反应前与反应后气体的密度之比为 |
D.混合气体中SO 的体积分数为 的体积分数为 |
用惰性电极以直流电串联电解分装在甲、乙两烧杯中的200mL0.3 mol·L-1 NaCl溶液和300mL0.2 mol·L-1的AgNO3溶液,当产生0.56L(标准状况下)Cl2时停止电解,取出电极,将两杯溶液混合,则混合液的pH为(设混合后溶液的总体积为500mL)()
| A.1.4 | B.7 | C.5.6 | D.12.6 |
在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?) xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是 ( )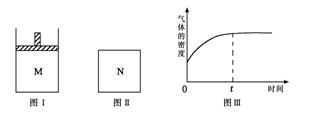
A.x=4
B.若N中气体的密度如图Ⅲ所示,则A、B都是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。下列说法正确的是( )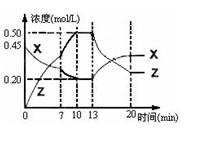
| A.用X表示0~10min内该反应的平均速率为0.025 mol/(L·min) |
| B.根据上图可求得方程式中a:b=2:1 |
| C.0~10min 容器内气体的压强逐渐增小 |
| D.第13min时曲线变化的原因可能是增加了Z的量 |