1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是21 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| D.NO2和N2O4的混合气体中,NO2的体积分数是80% |
下列叙述正确的是
| A.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 |
| B.SiO2是酸性氧化物,能与NaOH溶液反应 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.SO2通入盐酸酸化的BaCl2溶液中,会产生白色沉淀 |
下列有关物质检验的实验结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入足量盐酸,放出无色无味的气体,该气体能使澄清的石灰水变浑浊 |
该溶液中可能含有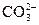 |
| B |
某溶液中加入浓NaOH溶液并加热,放出气体使湿润的红色石蕊试纸变蓝 |
该溶液中一定含有NH4Cl |
| C |
将某气体分别通入品红溶液、澄清的石灰水中,品红溶液退色、石灰水变浑浊 |
该气体可能是SO2或Cl2 |
| D |
两根玻璃棒分别蘸取浓氨水和某溶液,相互靠近时产生大量白烟 |
该溶液一定是浓盐酸 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
V |
| 原子半径/nm |
0.090 |
0.118 |
0.075 |
0.073 |
0.102 |
| 主要化合价 |
+2 |
+3 |
+5、+3、-3 |
-2 |
+6、-2 |
下列叙述不正确的是
A.X、Z、W位于同周期,Y与V位于同周期
B.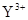 与
与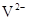 的核外电子数相等
的核外电子数相等
C.Y与W形成的化合物具有两性
D.Z的氢化物可与V的最高价氧化物的水溶液反应生成盐
核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构如图所示。
已知: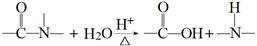
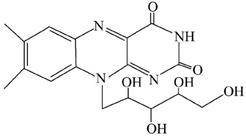
下列有关核黄素的说法中,不正确的是
| A.该化合物的分子式为C17H22N4O6 |
| B.酸性条件下加热水解,有CO2生成 |
| C.酸性条件下加热水解,所得溶液加碱后有NH3生成 |
| D.能发生酯化反应 |
A、B、C、D是中学化学中常见的四种物质,都含有同一种元素,A是单质,它们之间有如下转化关系: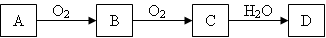
下面有关叙述不正确的是
A.若C是淡黄色固体,则A能与水反应放出氢气
B.若A是淡黄色固体,则C能使酸性KMnO4溶液退色
C.若C与水反应生成D的同时也生成了B,则A是空气的主要成分之一
D.若D是一种弱酸,则A与C可以在一定条件下反应生成B