前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。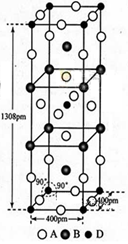
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是 。
简答:糖尿病是“富贵病”,请你设计实验检验病人尿液中的葡萄糖,并与正常人作对比,设计要求:
⑴写出实验所用化学药品
⑵写出实验现象并作出结论。
红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题: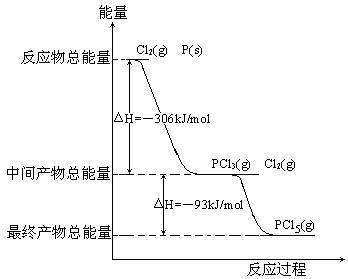
(1)PCl5分解生成PCl3和Cl2的热化学方程式;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2α1 (填“大于”,“小于”或“等于”);
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是;
(3)P和Cl2分两步反应生成1mol PCl5的△H3=。
(14分)某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式
,。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是
反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
(填写字母)。
a.乙酸 b.苯 c.乙醇 d.乙醛
要除去该物质,可在混合液中加入 (填写字母)。
a.氯化钠溶液 b.乙醇 c.碳酸氢钠溶液 d.四氯化碳
氯气是一种有毒气体,但它是一种重要的化工原料,与我们的生活联系也比较密切。
(1)据新闻报道,前不久某地装运液氯的槽罐车发生交通事故,造成大量氯气泄漏,公路附近的村民被紧急疏散。请问:村民应该如何应变(填编号)。
| A.应躲到低洼的地方去 | B.可用烧碱溶液浸湿软布蒙面 |
| C.可用肥皂水或尿液浸湿软布蒙面 | D.应多饮水 |
E.应到较高的地方去
(2)实验室制取氯气的方法有很多种,其中之一是:KClO3+6HCl=KCl+3Cl2↑+3H2O。该反应中氧化剂是,还原剂是,当反应生成标准状况下6.72LCl2时,转移电子的物质的量为。
(3)日常生活环境可用稀的漂白液等进行消毒,请写出制漂白液的离子方程式
。
下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
据此,请回答下列问题:
(1)写出物质的化学式:A ,D ,F 。
(2)写出下列变化的化学方程式:
B→C 。
E→C 。