氯气是一种有毒气体,但它是一种重要的化工原料,与我们的生活联系也比较密切。
(1)据新闻报道,前不久某地装运液氯的槽罐车发生交通事故,造成大量氯气泄漏,公路附近的村民被紧急疏散。请问:村民应该如何应变 (填编号)。
| A.应躲到低洼的地方去 | B.可用烧碱溶液浸湿软布蒙面 |
| C.可用肥皂水或尿液浸湿软布蒙面 | D.应多饮水 |
E.应到较高的地方去
(2)实验室制取氯气的方法有很多种,其中之一是:KClO3+6HCl=KCl+3Cl2↑+3H2O。该反应中氧化剂是 ,还原剂是 ,当反应生成标准状况下6.72LCl2时,转移电子的物质的量为 。
(3)日常生活环境可用稀的漂白液等进行消毒,请写出制漂白液的离子方程式
。
(8分) “低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
请回答下列问题:
(1)工艺操作②为:____________。
(2)工业合成氨的化学方程式为:____________________。
(3)副产品的化学式为_________。该联合生产工艺中可以循环使用的物质是_________________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________________。
(5)写出生成“产品”的化学方程式:_______________________
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
||
| 4 |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号或化学式,下同),非金属性最强的元素是:。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:_______,碱性最强的化合物的化学式是:_____________。
(3)最高价氧化物是两性氧化物的元素是:_________;写出它的最高价氧化物与氢氧化钠反应的离子方程式:____________________________________。
(4)④与⑧形成的化合物的电子式是:,该化合物所含化学键类型是:(填“共价键”或“离子键”)。
(5)试设计实验方案比较④与⑤的化学性质(金属性),有关实验步骤、现象和结论填入下表
| 实验步骤 |
实验现象与结论 |
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应: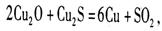
该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(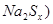 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体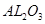 陶瓷(可传导
陶瓷(可传导 )为电解质,其原理如图所示:
)为电解质,其原理如图所示: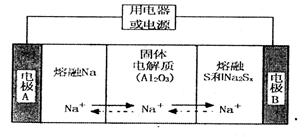
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。
②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为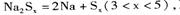 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
以化学反应原理为依据,以实验室研究为基础,可以实现许多化工生产。
I分解水制取氢气的工业制法之一是“硫-碘循环法”,主要涉及下列反应:
分析上述反应,下列判断正确的是____。
循环过程中产生1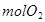 的同时产生
的同时产生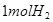
反应①中 还原性比
还原性比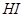 强
强
循环过程中需补充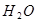
反应③易在常温下进行
在一定温度下,向2L密闭容器中加入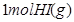 ,发生反应②.物质的量随时间的变化如图所示。
,发生反应②.物质的量随时间的变化如图所示。 内的平均反应速率
内的平均反应速率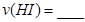
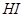 的转化率=_______
的转化率=_______
恒温恒容条件下,硫发生转化的反应过程和能量关系如图所示。 请回答下列问题:
请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式_______;
②恒温恒容时, 和
和 充分反应,放出热量的数值比
充分反应,放出热量的数值比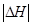 _____(填“大”、“小”或“相等”)
_____(填“大”、“小”或“相等”)
II.氮化硅(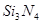 )是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
)是一种新型陶瓷材料,工业上有石英与焦炭在高温的氮气流中,通过以下反应制得:
该反应平衡常数的表达式为K=_______.升高温度,其平衡常数
_________(填“增大”、“减少”或“不变”)。
(2)该化学反应速率与反应时间的关系如图所示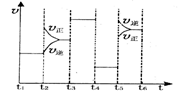
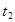 时引
时引 起突变的原因是_____,
起突变的原因是_____, 引起变化的因素是_____,
引起变化的因素是_____, 时引
时引 小变化、
小变化、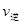 大变化的原因是_________.
大变化的原因是_________.
【原创】Ⅰ.(6分)将等物质的量的Fe2O3与FeCl3置于密闭管中加热,能恰好完全反应,且只生成一种产物X,其物质的量是反应物总物质的量的1.5倍,已知产物X难溶于水,易溶于强酸。
(1)产物X的化学式为 ;
(2)写出X溶于稀盐酸的离子方程式 ;
(3)某小组将X固体与足量钠在隔绝空气条件共热,发现有一种新的单质生成。设计实验证明这种单质。
。
【改编】Ⅱ.(12分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L―1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。