将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)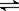 2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
| A.该条件下反应的平衡常数为1.6×103 |
| B.通常情况下,该反应一定能自发进行 |
| C.题给条件下,O2的转化率是20% |
| D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态 |
下列各组中两种气体所含的原子数一定相等的是
| A.温度相同,体积相同的O2和N2 |
| B.质量相等,密度不等的N2和CO |
| C.体积相等,密度相等的CO和C2H4 |
| D.压强相同、体积相同的N2和O2 |
用下列实验装置进行相应实验,能达到实验目的的是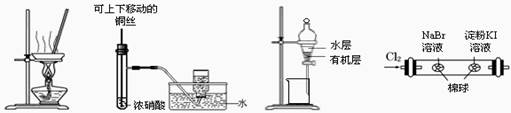
图1图2图3图4
| A.用图1所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
| B.用图2所示装置,制备并收集少量NO2气体 |
| C.用图3所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图4所示装置,可以证明氧化性:Cl2>Br2>I2 |
卤素互化物与卤素单质性质相似。已知CH2=CH-CH=CH2(1,3-丁二烯)与氯气发生1∶1加成产物有两种:
①CH2Cl-CHCl-CH=CH2(1,2-加成)②CH2Cl-CH=CH-CH2Cl (1,4-加成)
据此推测CH2=C(CH3)-CH=CH2(异戊二烯)与卤素互化物BrCl的1∶1加成产物有几种(不考虑顺反异构和镜像异构)
| A.6种 | B.7种 | C.8种 | D.9种 |
恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)
MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见下表:
| 反应时间/min |
n(MgSO4)/mol |
n(CO)/mol |
n(SO2) / mol |
| 0 |
2.0 |
2.0 |
0 |
| 2 |
0.8 |
||
| 4 |
1.2 |
||
| 6 |
1.2 |
2.8 |
下列说法正确的是
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)="0.6" mol
依据下列实验现象,得出的结论正确的是
| 选项 |
操作 |
实验现象 |
结论 |
| A |
向NaBr溶液中加入氯水,再加入淀粉KI溶液 |
溶液变蓝 |
氧化性:Cl2>Br2>I2 |
| B |
将铝片放入盐酸中 |
产生气泡的速率先慢后快,再逐渐减慢 |
H+的浓度是影响反应速率的唯一因素 |
| C |
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜加热 |
得到蓝色溶液 |
蔗糖水解产物没有还原性 |
| D |
向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液 |
品红溶液褪色 |
气体中含有Cl2 |