[物质结构与性质]
物质结构的多样性让人类使用的材料精彩纷呈。
(1)图是原子序数相连的七种短周期元素第一电离能示意图。其中硼元素是 (填图中元素代号)。
(2)②③两种元素组成的化合物与③④两种元素组成的化合物为等电子体,写出与其等电子体的一种离子化学式
(3)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为 草酸钠晶体中存在 (填图中元素代号)。
草酸钠晶体中存在 (填图中元素代号)。
A金属键 B非极性键 C键 D范德华力 E氢键 F离子键
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为 ;若碳酸 中的碳氧原子都在同一平面,则碳原子的杂化类型是 。
(5)PtCl4和氨水反应可获得PtCl4• 4NH3,PtCl4•4NH3是一种配合物。100mL0.1mol•L-1PtCl4•4NH3 溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀。该配合物溶于水的电离方程式为 。
在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。(装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去)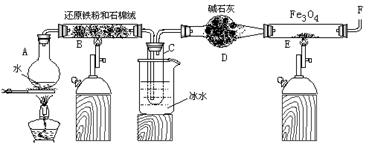
(1)烧瓶A中常加入碎瓷片,其作用是,B中石棉绒的作用,小试管C的作用是。
(2)反应开始时先点燃处(填A或B)酒精灯,为了安全,在E管中的反应发生前,在F出口处必须,E管中的反应开始后,在F出口处应。
(3)写出高温下Fe 与H2O(g)反应的化学方程式,在一定条件下该反应实际上是可逆反应,试用化学平衡移动原理加以解释本实验中是如何实现Fe向Fe3O4的转变的。
(4)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象____________________________________________________。
粉末状试样A是由等物质的量的MgO和Fe2O₃组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20克A全部溶于0. 15L 6mol·L -1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L气体(标准状况),同时生成溶液D,还有残留固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是,
产物中的单质B是。
(2)②中所发生的各反应的化学方程式是、。
(3)③中所发生的各反应的离子方程式是、。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为,c(Fe2+)为。
有一块铝铁合金,将其溶于足量盐酸中,再加入过量氢氧化钠溶液,在空气中静置至红褐色沉淀不再增加为止,将沉淀滤出再灼烧至恒重,得到残留固体的质量与原合金的质量相同,则:
(1)合金溶于足量盐酸所得溶液中含有的阳离子有、、;
(2)沉淀滤出再灼烧至恒重,得到残留固体的化学式为;
(3)将沉淀滤出后所得的滤液中存在的阴离子有、、;
(4)合金中铝的质量分数为 。
实验室常用硫酸铝溶液和氨水反应制取氢氧化铝,其离子方程式为;
溶液中得到的氢氧化铝是______色______状物质。它是______溶于水的______性化合物,既能与______反应,又能与______反应,其离子方程式分别是、。
(1)铁是人体中重要的微量元素,血红蛋白中存在价铁;医学上常用硫酸亚铁糖衣片治疗贫血,药片上糖衣的作用是。
(2)明矾可用作净水剂,写出硫酸铝钾的电离方程式;明矾能净水是因为Al3+的水解产物能吸附水中的悬浮杂质而沉降。
(3)白炽灯用金属钨作灯丝是因为。
(4)地壳中含量最多的金属是,人体中含量最多的金属是。