红枣包装中常使用一种“504双吸剂”,其成分为铁粉、生石灰等。实验小组同学对一包使用过的“504双吸剂”进行了如下探究。
【提出问题】使用后固体的成分是什么?
【查阅资料】Fe + 2FeCl3 === 3FeCl2
【进行猜想】固体成分可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3。
【进行实验】
甲同学的实验记录:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量固体放入试管中,滴加一定量的 ,用带导管的单孔塞塞紧试管口,导管另一端伸入澄清石灰水中。 |
试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊。 |
固体中一定含有 , 不含Fe2O3。 |
| 取少量固体放入试管中,加水溶解,静置后取上层清液滴加无色酚酞溶液。 |
试管底部有不溶物, 。 |
固体中含有氧化钙和氢氧化钙。 |
实验质疑:你认为甲同学得出的实验结论是否正确,并阐述理由: 。
乙同学的实验:
综合上述实验过程和数据回答问题:
① 加足量碳酸钠溶液时发生反应的化学方程式为 。
②“504双吸剂”使用后固体的成分是 。
【反思与评价】
依据甲、乙同学的实验,得出的下列结论中,正确的是 (填字母序号)。
A.甲同学实验中得到的浅绿色溶液中溶质一定有FeCl2、CaCl2
B.乙同学实验过程中共有3个反应发生
C.乙同学实验中得到的黄色溶液中溶质为FeCl3、CaCl2
D.甲、乙两位同学实验中都有气体产生,但生成的气体成分不同
氢化钙(CaH2)是一种储氢材料,是登山运动员常用的能源提供剂。甲、乙两位同学选用如下装置,用氢气与金属钙加热制备氢化钙。实验结束后,两位同学对硬质玻璃管中的固体进行如下探究: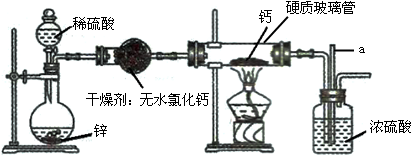
【提出问题】硬质玻璃管中的Ca是否完全转化为CaH2?
【查阅资料】
① 金属钙活动性很强,遇水反应生成氢氧化钙,同时产生一种气体;
② 氢化钙要密封保存,遇水反应放出氢气。
【猜想与实验】
1、固体为Ca和CaH2。
2、固体为CaH2。
甲同学的探究活动如下:
| 实验操作 |
实验现象 |
实验结论及解释 |
| ① 取少量硬质玻璃管中的固体于试管中,滴入少量的水,收集产生的气体,并用燃着的木条点燃 |
有氢气生成 |
|
| ② 继续向溶液中滴加酚酞 |
呈红色 |
生成(填化学式) |
甲同学的结论:猜想1正确,固体为Ca和CaH2。
【实验反思】
乙同学认为由以上探究活动还不能得出猜想1正确,理由是。请你帮助乙设计实验,写出主要的实验步骤、现象和相应的结论:
。
【反思讨论】
(1)写出CaH2与水反应的化学方程式。
(2)登山运动员常用氢化钙固体作能源提供剂,与氢气相比,其优点是。
(3)制备CaH2装置中,玻璃管a的作用是。
化学小组同学用下图所示装置(夹持仪器已略去)做兴趣实验。分液漏斗及C装置中所盛放的溶液相同,B、C装置中盛放的溶液足量,气球中装有少量的白色固体粉末。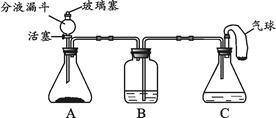
(1)打开分液漏斗的活塞和玻璃塞,使A装置与大气相通,将气球中的少量粉末全部倒入C中,可以观察到C装置中有无色气泡逸出,白色固体消失,气球微微鼓起,B中溶液变浑浊。产生上述现象的原因是(用化学方程式表示)。
(2)待上述反应结束后,从分液漏斗注入足量的溶液,关闭活塞和玻璃塞。B装置中的现象及产生此现象的原因是。请将下表中的试剂补充完整。
| A |
C /分液漏斗 |
气球中粉末 |
|
| 试剂 |
Mg |
根据实验内容回答问题。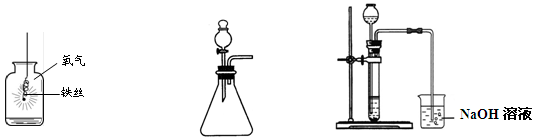
A B C
(1)图A铁丝在氧气中剧烈燃烧,,放出大量的热,有黑色固体生成。该反应的化学方程式为。
(2)图B装置用于制取氧气,反应的化学方程式为,除图中所示的方法外,在实验室中氧气还可用(用化学反应方程式表示)方法制取。
(3)用稀盐酸和大理石在C装置中反应制CO2,反应的化学方程式为;并验证CO2有关性质,观察到烧杯中导管口有气泡冒出,但无其他明显现象。若证明CO2与NaOH溶液发生了化学反应,以下方案合理的是______(填序号)。
① 取少量烧杯中液体滴加无色酚酞
② 取少量烧杯中液体滴加足量稀盐酸
③ 取少量烧杯中液体滴加足量石灰水
(1)小方用右图所示装置对二氧化碳的灭火实验进行研究,观察到的现象是______,实验的结论是_______。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①右图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。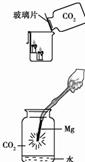
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是______;反应的化学方程式是______。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
开始_______,后有白色沉淀产生。 |
白烟的成分是______。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。
下面三个实验采用的是对比实验方法进行的有关探究。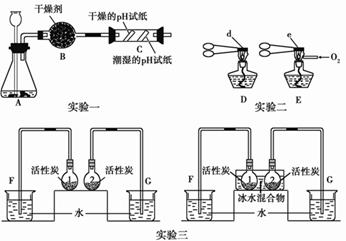
(1)用实验一所示装置进行二氧化性质的探究。
当长颈漏斗中的稀盐酸与锥形瓶中的大理石接触后,有大量气泡产生,该反应的化学方程式是;C中观察到的现象是。
(2)用实验二进行石灰石性质的探究。
用两支坩埚钳分别夹持大小相同的石灰石固体d、e,向 E中酒精灯的火焰通氧气,受热相同时间后冷却,将固体d、e固体分别放入盛有酚酞溶液的烧杯中,前者溶液不变色,后者溶液变为红色。则向酒精灯火焰通氧气的目的是。通过上述实验对比分析,可得出的结论是。
(3)用实验三所示装置进行活性炭吸附能力的实验探究。
实验开始时,在常温常压条件下,烧瓶1内为氮气,烧瓶2内为相同体积的氯气,将相同质量的活性炭装入两支烧瓶后,F侧导管中的液面与烧杯内水的液面基本一致,G侧导管中的液面高于烧杯内水的液面。当将两只烧瓶放入冰水混合物中,观察到两侧导管中液面都有所上升,且G侧上升的高度比F侧明显。通过该对比实验可以得出的结论是。