用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是 ( )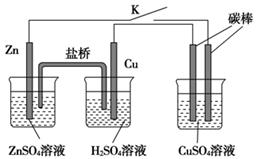
| A.铜棒为正极,其电极反应式为:2H++2e-====H2↑ |
| B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出 |
| C.反应中消耗锌的质量为13 g |
| D.导线中通过电子的物质的量为0.2 mol |
已知方程式2H2(g)+O2(g)=2H2O(l) △H1=–571.6KJ·mol-1,则关于方程式
2H2O(l) =2H2(g)+O2(g) △H2=?的说法正确的是( )
| A.方程式中化学计量数表示分子数 |
| B.该反应△H2大于零 |
| C.该反应的△H2=-571.6kJ·mol-1 |
| D.该反应可表示36g水分解时的热效应 |
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热
量,下列热化学方程式正确的是()
A.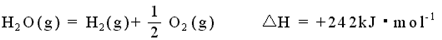 |
B.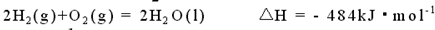 |
C. |
D.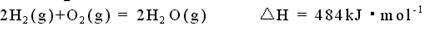 |
反应4A(s)+3B(g)="=" 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是()
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是()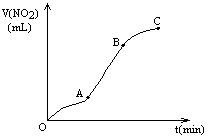
| A.A段表示开始时,反应速率稍慢 |
| B.B段表示反应速率较快,可能因为产物有催化作用 |
| C.BC段表示反应速率最快,在该时间内收集到的气体最多 |
| D.OC线表示随时间增大,反应速率逐渐增大 |
下列关于化学反应速率的说法中正确的是()
| A.对任何化学反应来说,反应速率越大,反应现象就越明显 |
| B.化学反应速率通常用单位时间内任何一种反应物浓度的增加或生成物浓度的减少来表示 |
| C.若某化学反应的反应速率为0.5mol·(L·S)-1就是指在该时间内反应物和生成物的浓度变化都为0.5 mol·L-1 |
| D.化学反应速率用于衡量化学反应进行的快慢 |