有一实验事实:铁粉与硫酸铜溶液反应,不但有铜生成,而且有较多的气体产生。为确定气体的成分,进行下列实验探究。
(一)探究:从物质组成元素角度分析,气体可能是SO2、O2、H2中的一种或几种。
(二)实验:
(1)甲同学为确定是否含有SO2,他将气体通入酸性高锰酸钾溶液中,溶液颜色未发生变化,则该气体中 SO2(填“有”或“无”)。
(2)乙同学认为只有O2,则可用 来检验。实验证明乙同学的观点不正确
(3)丙同学为判断是否含有O2,同时确定气体成分,通过查阅资料得知:
O2+4KI+4HCl ="==" 2I2+4KCl+2H2O,I2为碘单质。于是他设计了如下的实验装置: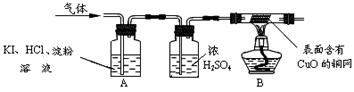
(三)实验现象与结论:A中观察到 ,证明无O2;
B中观察到 ,证明该气体是H2。
(四)实验反思:
(4)大家认为丙同学在加热之前,应对气体先 以确保安全。
(5)由上述实验可知,硫酸铜溶液显 性(填“酸”或“碱”)。
(1)化学小组的同学在做镁条在空气中燃烧实验时,发现生成的白色固体中还夹杂着少量的淡黄色的固体。
【提出问题】为什么会生成淡黄色固体?
【查阅资料】记录了下列几种物质的颜色:
| 物质 |
MgO |
MgCl2 |
Mg3N2 |
Mg(NO3)2 |
MgCO3 |
Mg(OH)2 |
| 颜色 |
白色 |
白色 |
淡黄色 |
白色 |
白色 |
白色 |
小红同学认为不必查阅氯化镁的颜色,理由是:。
【提出猜想】分析资料小红认为淡黄色固体可能是和空气中的反应生成的。
【实验探究】小红设计实验来验证自己的猜想,他的方案可能是:。
【实验结论】根据小红的实验结果,写出镁条在空气中燃烧的两个化学反应方程式:
①; ②。
【反思与评价】通过上述实验,你对燃烧有什么新认识。
小明同学学习了金属的化学性质后,想对“锌与硫酸反应快慢的影响因素”进行探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与硫酸的质量分数有关
②可能与锌的形状有关
【设计并实验】小明用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 |
硫酸的质量分数 (均取20ml) |
锌的形状 (均取1g) |
氢气的体积(ml) (均收集3分钟) |
| ① |
20% |
锌粒 |
31.7 |
| ② |
20% |
锌片 |
50.9 |
| ③ |
30% |
锌粒 |
61.7 |
| ④ |
30% |
锌片 |
79.9 |
(1)写出锌与稀硫酸反应的化学方程式。
(2)小明用如图装置收集并测量氢气的体积,其中量筒的作用是,氢气应从(填e或f)管通入。
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是。
【提出问题】(4)结论是。
(,宜宾)小明家有包开启了的小苏打,久置在灶台上方,可能因受热而变质。小明为此开展了探究,请分析其过程完成填空。
【查阅资料】
① 2NaHCO3 Na2CO3+ CO2 ↑ + H2O
Na2CO3+ CO2 ↑ + H2O
② NaHCO3+ NaOH = Na2CO3+ H2O
③ 2NaHCO3+ Ca(OH)2= CaCO3 ↓ + Na2CO3+ 2H2O
④ Ca(HCO3)2+ Na2CO3= CaCO3 ↓ + 2 NaHCO3
⑤ Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶与水。
【假设猜想】
假设一:小苏打没有变质,化学成分为 NaHCO3;
假设二:小苏打完全变质,化学成分为;
假设三:小苏打部分变质,化学成分为。
【实验方案】
可选药品:①Ca(OH)2溶液②CaCl2溶液③NaOH溶液④稀盐酸
| 实验操作 |
实验现象 |
实验结论 |
| 操作一:取小苏打样品少量溶于足 量水后,加入过量的(填药品编 号,下同),观察,如有沉淀,则继续进行下一步操作。 操作二:待操作一中反应充分后过 滤,并在滤液中加入过量的,观察。 |
操作一中无沉淀出现 |
假设一成立 |
| 假设二成立 |
||
| 假设三成立 |
【问题讨论】
有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现
象,对上述三种假设的每一种是否成立都能进行判断。请评价这种方案是否合理
(填“是”或“否”),理由是。
某合作学习小组为探究二氧化碳的化学性质,做了以下实验:他们取一张用石蕊染成紫色的干燥的试纸,放到已通入二氧化碳的水中,观察到试纸变成红色。由此部分同学判断:二氧化碳能使紫色石蕊试纸变成红色。请你围绕该问题进行探究:
(1)你认为这些同学的判断正确吗?_________________
(2)如果正确,请说明理由;如果不正确,请你设计还需进行的实验,以得出满意的结论。(简要叙述实验步骤、现象和结论,用语言或图示均可)
__________________________
__________________________。
某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气。根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐。
【猜想与假设】
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解。
乙同学:铁钉里的加快了H2O2的溶液分解。
【设计方案和实验】完成下列表格
| 实验方案 |
实验现象 |
结论 |
| 方案一:向盛有10mL 5% H2O2溶液的试管中加入2g 氧化铁粉末,将一根带火星的木条放在试管口,观察现象。 |
甲同学结论成立。 |
|
| 方案二:向盛有10mL 5% H2O2溶液的试管中加入粉末,将一根带火星的木条放在试管口,观察现象。 |
无现象 |
乙同学结论。 (填“成立”或“不成立”) |
【讨论交流】丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂。你是否支持丙同学的观点?,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是。
【拓展】
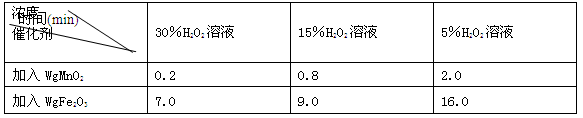
(1)实验证明Fe2O3粉末可以作为H2O2分解的催化剂。该反应的文字表达式
(2)下表是丙同学探究影响H2O2分解速率时所记录的部分数据,通过对数据分析,你能得出什么结论?。
用足量等体积H2O2溶液制取相同体积O2所需的时间: