著名侯氏制碱法的重要反应之一:NH3 +CO2 +H2O+NaCl ="=" NaHCO3 +NH4Cl。在生产中,NaHCO3易结晶析出,经过滤得到NaHCO3晶体和滤液。某化学兴趣小组欲探究所得滤液中溶质的成分,及制得的纯碱样品中Na2CO3的质量分数,请你参与他们的探究活动。
【查阅资料】Ⅰ.碳酸钠和氯化钙能发生复分解反应。
Ⅱ.2NaHCO3 △ Na2CO3 +CO2↑+H2O; NH4Cl △ NH3↑+HCl↑。
Ⅲ.NaCl溶液与AgNO3溶液反应产生不溶于稀HNO3的白色沉淀。
【探究实验1】滤液中含有的溶质是什么?
【作出猜想】猜想1:NH4Cl 猜想2:NaHCO3 猜想3:NaCl
猜想4:……
【交流与讨论】(1)化学兴趣小组认为溶质含有NaCl,理由是 。
(2)化学兴趣小组经过讨论,认为猜想4可能是 。
【实验推断】
| 实验步骤 |
实验现象 |
实验结论及分析 |
| ①取少量滤液于试管中,滴加足量的NaOH浓溶液后加热,并将湿润的红色石蕊试纸放在试管口。 |
|
滤液中含有NH4Cl,有关化学方程式: NaOH + NH4Cl =" NaCl" + NH3↑+ H2O |
| ②另取少量滤液于试管中,滴加稀盐酸。 |
产生无色 无味气体。 |
滤液中含有 ,有关化学方程式: 。 |
| ③另取少量滤液蒸干后充分灼烧,取灼烧后的残余固体溶于水,滴加稀HNO3,再滴加AgNO3溶液。 |
产生白色沉淀。 |
滤液中含有 ,滤液蒸干后充分灼烧的目的是 。 |
【探究实验2】测定NaHCO3晶体受热后所得粉末中Na2CO3的质量分数。
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
| 实验操作 |
实验现象 |
实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液。 |
产生白色沉淀。 |
反应的化学方程式: 。 |
(2)分析滴加的CaCl2溶液要过量的原因: 。
(3)应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量。利用沉淀物质量计算Na2CO3 的质量分数为96%。如果不洗涤沉淀物会造成测定结果大于96%,这是因为 。
下列是初中化学部分重要的实验装置。请按要求填空: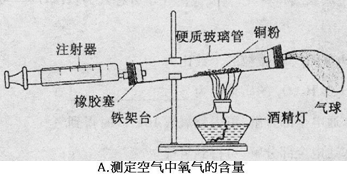

(1)A中为了测定空气中氧气的含量,采用化学方法除去空气中的氧气,发生反应的化学方程式:;若装置气密性良好,实验所测得氧气的含量小于21%,其原因可能①,②。
(2)B实验a中看到的现象是,用化学方程式表示该现象的原因;b装置中的现象能说明二氧化碳具有性质,这一性质在实际生活中的应用为。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是。
小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 |
镁 |
含碳0.05%的铁 |
含碳0.2%的铁 |
含碳0.6%的铁 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
(未填) |
①你认为表中未填的实验现象是。
②造成铁丝在氧气中燃烧时火星四射的主要原因是。
控制变量法是实验探究的重要方法。利用下图所示实验不能实现的探究目的是
| A.甲中①②对比可探究铁的锈蚀与植物油是否有关 |
| B.甲中①③对比可探究铁的锈蚀与水是否有关 |
| C.乙可探究可燃物的燃烧是否需要达到一定温度 |
| D.乙可探究可燃物的燃烧是否需要与氧气接触 |
旺旺雪饼的包装袋内,放有一袋白色固体,上面写着“干燥剂、主要成分为生石灰”。同学们对在空气中放置一段时间的干燥剂进行了探究,根据生石灰的性质变化,设计了下列实验。
【实验操作1】下面是小昊同学设计的探究白色固体组成的实验方案,请你和他一起完成实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| A.将样品研碎放入水中,充分搅拌,静置。 |
底部有大量白色不溶物出现 |
白色固体中含有碳酸钙 |
| B.取上层清液,滴加无色酚酞试液。 |
溶液变为 |
白色固体中含有氢氧化钙 |
同学们讨论,认为小昊同学两个结论都不准确,A是因为,
B是因为(用方程式表示)。
【实验操作2】小宇同学新设计的探究白色固体组成的实验方案,请你和他一起完成实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| 1.取样品放入盛有水的试管中,用温度计测量水温先后的情况 |
温度升高 |
|
| 2.取样品放入研钵,与硝酸铵一起碾磨 |
|
白色固体中含有氢氧化钙 |
| 3.取样滴加稀盐酸 |
有气泡产生 |
|
【拓展与应用】
由小宇实验2(样品与硝酸铵一起碾磨)知道施用铵态氮肥时应注意 。
课外小组的同学上网查阅有关金属资料时,看到镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物。于是产生疑问:产生的气体和白色不溶物是什么物质?在老师的帮助下,他们进行了如下探究。
探究一 :产生的无色气体是什么物质?
| 实验序号 |
实验操作 |
实验现象 |
解释及结论 |
| 实验I |
用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 |
迅速反应,产生大量气泡和白色不溶物 |
 |
| 实验Ⅱ |
将实验I中收集到的气体点燃,并在火焰上方罩一干、冷的小烧杯 |
气体安静燃烧、产生淡蓝色火焰,烧杯内壁有水雾出现。 |
该气体是,燃烧的化学方程式为 。 |
探究二:产生的白色不溶物是什么物质?
【查阅资料】
1.碱石灰是固体氢氧化钠和氧化钙的混合物。
2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
【猜想与假设】
猜测1:白色不溶物可能为Mg(OH)2
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能是Mg (OH)2和MgCO3的混合物
实验Ⅲ ①取洗净后的白色固体,加入足量的溶液,观察到固体溶解,产生无色气泡,则白色固体一定含有。(填名称)
②称取实验I中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中。
实验后装置A增重1.8g,则白色固体中还含有,装置B增重8.8g,试确定白色不溶物中各成分的质量比为:。
【实验反思】通过上述实验说明,对于未知物成分的确定,可以采取两种不同的实验方法,这两种方法分别是,。
不少同学都被蚊虫叮咬过,感觉又痛又痒。同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内释放出蚁酸刺激皮肤,课外兴趣小组同学决定对蚁酸进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;蚁酸在一定条件下会分解生成两种氧化物。
【实验探究一】探究蚁酸的酸性。
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成色,说明蚁酸溶液显酸性;
(2)将锌粒放入盛有蚁酸溶液的试管中,有气泡产生,该气体是(填名称)。
【实验探究二】探究蚁酸分解的两种产物。
(1)小芳同学根据蚁酸中含有元素,推测出生成物中含有水;
(2)另一种生成物是气体,小敏提出两种猜想:
猜想①:该气体是CO2猜想②:该气体是
他们将蚁酸分解产生的气体通过如下装置(铁架台已略去),观察现象。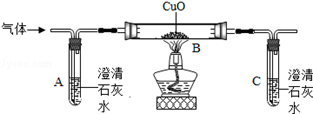
Ⅰ.实验时装置A中无明显变化,则猜想①(填“成立”或“不成立”);
Ⅱ.装置B中的现象是,装置C中发生反应的化学方程式为。
【讨论交流】从环保角度看,该装置的缺陷是。
【拓展延伸】
(1)当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是。
| A.牙膏 | B.食醋 | C.肥皂水 | D.烧碱 E.苏打水 |
(2)向某溶液中加入蚁酸有气泡产生,该气体能使澄清石灰水变浑浊,则该溶液中溶质的化学式可能是(只写一种)。