为测定某盐酸中溶质的质量分数,小荣同学取该盐酸样品50g,向其中加入过量锌粒,完成反应后收集到0.3g氢气,请完成下列计算与分析:
⑴计算该盐酸中溶质的质量分数。
⑵小荣将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸、溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是 。
钢铁的生产和使用是人类文明和社会进步的一个重要标志.
(1)每年钢铁锈蚀都会造成巨大的损失,铁制品锈蚀的主要原因是________________________________________.
(2)校课外兴趣小组的同学取潍坊某钢铁厂生铁样品进行实验:将四份不同质量的生铁样品(假定其中只含单质铁和单质碳)分别加到100g质量分数相同的稀硫酸中,充分反应后,测得的实验数据如下表:(已知:在标准状况下,22.4L H2的质量为2g)
| 实验序号 |
1 |
2 |
3 |
4 |
| 生铁样品的质量/g |
2.88 |
5.76 |
9.24 |
10.28 |
| 生成H2的体积(标准状况下)/L |
1.12 |
2.24 |
3.36 |
m |
通过计算回答下列问题:
①上述表格中m的值为________.
②根据表中数据计算稀硫酸中H2SO4的质量分数.
请你利用图中所提供的3个数据,自拟一道有关化学方程式的计算题,并写出解答过程.
在工业制取硫酸的过程中,有发生如下反应:4FeS2+11O2 2Fe2O3+8SO2.现有含FeS2 60%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2-120SO2-64)
2Fe2O3+8SO2.现有含FeS2 60%的黄铁矿100t(假设杂质不参加反应),最多可生产SO2多少吨?(相对分子质量:FeS2-120SO2-64)
某工厂利用废铁屑与废硫酸起反应来制取硫酸亚铁。现有废硫酸49t(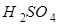 的质量分数为10%),与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
的质量分数为10%),与足量的废铁屑起反应,可生产硫酸亚铁的质量是多少?
把10g铁和铜的混合物放到盛有足量盐酸的烧杯中,充分反应后,烧杯中物质的总质量比反应前(铁、铜混合物和盐酸)减少了0.2g,求原混合物中铜的质量分数.