下表中列出五种短周期元素X、Y、Z、W、T的信息。
| 元素 |
相关信息 |
| X |
基态原子最外层电子排布为nsnnpn+1 |
| Y |
其原子L层电子数是K层3倍 |
| Z |
其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W |
其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T |
其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。
(4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。
(5)已知25℃、101 kPa下:
①2Z(s)+ 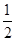 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。
下表有三组物质,每组均有甲、乙、丙三种物质(酸碱盐均为溶液)
| 第一组 |
第二组 |
第三组 |
|
| 甲 |
BaCl2 |
NaOH |
Cu(NO3)2[来源 |
| 乙 |
Fe2O3 |
K2SO4 |
H2SO4 |
| 丙 |
Mg |
Fe |
MgCl2 |
(1)第二组中____(填化学式)与第一组所有物质都不反应,但与第三组所有物质都能反应;
(2)第三组中有一种物质能与第一组中的所有物质反应,这种物质是__________(填化学式)。
请写出相关化学方程式,并判断是否为氧化还原反应。(填“是”或“否”)
| 相关化学方程式 |
氧化还原反应 |
|
| ①与甲 |
||
| ②与乙 |
||
| ③与丙 |
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为
(2)现有一含有FeCl2和FeCl3的混合样品,测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为___ _。证明混合物中存在Fe2+的操作:,在实验室中,FeCl3可用铁粉和_______反应制备.
(3)有学生利用FeCl3溶液制取FeCl3·6H2O晶体主要操作包括:滴入过量盐酸,、冷却结晶、过滤。过滤中要用到的玻璃仪器有漏斗、烧杯和。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为___。
A、B、C、D、E五种常见化合物,都是由下面中的离子形成的:阳离子:K+、Na+、Al3+、Fe3+阴离子:HCO3—、SO42—、OH-、 Cl—
为了鉴别上述化合物,分别完成以下实验,其结果是:
① 将它们溶于水后,A为棕黄色溶液,其他均为无色溶液;
② 将它们进行焰色反应,仅有C、E为紫色(透过蓝色钴玻璃);
③ 将B溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
④ 在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有D中放出无色气体,只有A、C中产生白色沉淀;
⑤ 将A、E两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出的化学式:A____,C。
(2)写出B和D反应的离子方程式。
(3)进行焰色反应实验操作时,使用铂丝前应该用________洗涤。
(4)在D溶液中加入少量澄清石灰水,其离子方程式为____
(5)向100mL 1mol/L C溶液中加入0.2 molBa(OH)2溶液,充分反应后得到溶质是
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中发生了氧化还原反应的是( )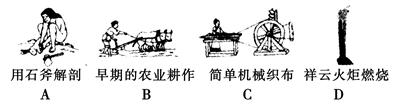
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。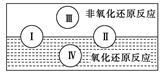
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式:_ _
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应离子方程式是
MnO4-+ NO2-+ ===== Mn2++ NO3-+ H2O
===== Mn2++ NO3-+ H2O
Ⅰ、请补充完整,配平方程式并标出电子转移方向和数目
Ⅱ、某同学称取了7.9 g KMnO4固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是: 。
Ⅲ、不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小 (请填序号):
①在溶解过程中有少量液体溅出烧杯外
②定容时仰视仪器上的刻度线
③定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
IV、最后所得的溶液应存放在试剂瓶中,并贴上标签,请你填写该标签(如图)。
V、某同学用上述配好的KMnO4溶液滴定末知浓度的NaNO2溶液:
取20mL末知浓度的NaNO2溶液于锥形瓶;
取上述配好的KMnO4溶液于 (“酸式”或“碱式”)滴定管
滴定完成后消耗KMnO4溶液10mL则NaNO2溶液的浓度为
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的一些问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号)_________________。
| A.Na2O2+2HCl==2NaCl+H2O2 |
| B.Ag2O+H2O2 ==2Ag+O2↑+H2O |
| C.2H2O2==2H2O+O2↑ |
| D.3H2O2+Cr2(SO4)3+10KOH ==2K2CrO4+3K2SO4+8H2O |
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是___________(填字母代号)。
自燃物品氧化剂剧毒品腐蚀品
A B C D
(3)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO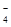 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2↑。
①该反应中发生还原反应的过程是__________________________________。
②如果上述反应中有6.72L(标准状况)气体生成,转移的电子数为_________。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+ H2O2+ H2O==A+NH3↑,试指出生成物A的化学式为__________________,并阐明H2O2被称为“绿色氧化剂”的理由是_______________________________________________________________________。