某温度(T℃)时,测得0.01mol/LNaOH溶液的pH为11,则该温度下水的KW=____________。则该温度________(填“大于”、“小于”或“等于”)室温,其理由是_______________________________________________________________________。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
(2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=________。
(3)若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=__________。
回答下列问题:
I.①~⑨是几种有机物的名称或化学式:
①2,2,3-三甲基丁烷、②3-甲基-1-氯戊烷、③甲苯、④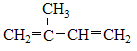 、⑤ClCH=CHCl、
、⑤ClCH=CHCl、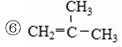
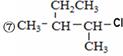
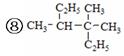

据此回答下列问题:
(1)用系统命名法命名有机物⑧和⑨:⑧_____________,⑨_____________。
(2)上述有机物中,互为同分异构体的是__________(用编号表示),互为同系物的是______________(用编号表示),存在顺反异构的是_______(用编号表示)。
(3)③苯环上的二氯代物有__________种,以该有机物为原料制备TNT炸药的化学方程式为_______
(4)丁基橡胶是④与2-甲基丙烯共聚生成。写出该橡胶的结构简式_________
II.根据官能团对性质有决定作用,基团对性质有影响作用,完成下列排序: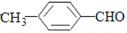
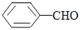
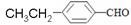
①上述三种物质溶解性由大到小的顺序_______________
②丙三醇、丙烷、乙二醇的沸点由高到低的顺序_______________
③苯酚、苯甲酸、醋酸的酸性由强到弱的顺序_______________
(提示:类比酚与醇的酸性)
III.某有机物蒸气0.1L与a LO2在一定条件下恰好燃烧,生成0.3L水蒸汽、0.1LCO2和0.1LCO(气体体积均在相同条件下测得)。
(1)a的最大值为_________,有机物的结构简式为________________。
(2)当有机物为乙二醇时,a的值为_____________。
2014年4月,英国《每日邮报》报道制造太阳镜、婴儿奶瓶、太空杯和光盘的主要材料都是聚碳酸酯,聚碳酸酯在一定条件下可释放出有毒的双酚A( )。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
)。聚碳酸酯不耐高温,100 ℃时释放出的双酚A是25 ℃时的50倍。双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病。请回答下列问题:
Ⅰ.下列关于双酚A的说法不正确的是________(填序号)
A.利用聚碳酸酯制成的茶杯来泡茶时对人体无害
B.双酚A的分子式是C15H16O2
C.双酚A的核磁共振氢谱显示有4组峰,且峰面积之比为1∶2∶2∶3
D.1 mol双酚A最多消耗2 mol Br2
Ⅱ.聚碳酸酯(简称PC)是分子链中含有碳酸酯基的高分子聚合物,其合成流程如下:
(1)反应①②③④⑤中属于取代反应的有________。
(2)CH3CH==CH2与Cl2加成产物的同分异构体有________种(不含加成产物)。
(3)写出反应⑤⑦的化学方程式:
反应⑤________________________。反应⑦________________________。
某物质E可做香料,其结构简式为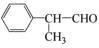 ,工业合成路线如下:
,工业合成路线如下: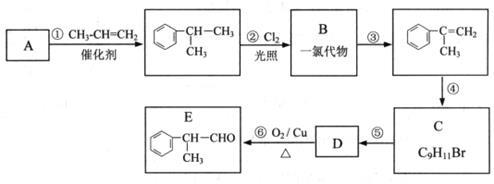
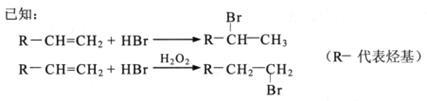
回答下列问题:
(1)A为芳香烃,相对分子质量为78。下列关于A的说法中,正确的是_____(填序号);
A. 密度比水大 B. 所有原子均在同一平面上 C. 一氯代物只有一种
(2)B的结构简式可能是____________、____________;
(3)步骤④的化学方程式是________________________;
(4)E有多种同分异构体,写出符合以下条件的结构简式___________(只写反式结构)。
①具有顺反结构 ②能与NaOH溶液反应 ③分子中苯环上的一溴代物有两种
(1)多羟基连在同一个碳原子上易自动失水生成醛或酮。请写出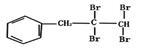 NaOH的水溶液共热的化学方程式为____________。
NaOH的水溶液共热的化学方程式为____________。
(2)苯腙是有机染料的主要原料,由醛(或酮)与苯肼生成苯腙的反应为:
反应①的原子利用率为100%,则中间产物A的结构简式为____________;
反应②的反应类型属于____________。
(3)由对苯二甲醛( )的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。
)的氧化产物“对苯二甲酸”与“乙二醇”发生缩聚,生成的聚酯纤维(涤纶)的结构简式为____________。
下图中A~J均为有机化合物。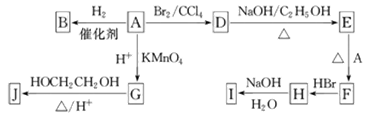
根据图中信息,回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为____________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为____________。
(3)由A生成D的反应类型是____________。
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为____________。
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应: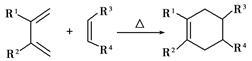 ,
,
则由E和A反应生成F的化学方程式为____________。