市场上出售的“热敷袋”其主要成分是铁屑、炭粉和少量的NaCl、水等。热敷袋在启用前用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓,就会放出热量,使用完后,会发现袋内有许多铁锈生成。回答:
(1)热敷袋放出的热量来源于_________放出的热量。
(2)炭粉的作用是________________________。
(3)加入NaCl的作用是________________________。
(4)写出有关电极反应式和化学方程式________________。
已知:A、B为常见的非金属单质且均为气体;甲、乙为短周期金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性。各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):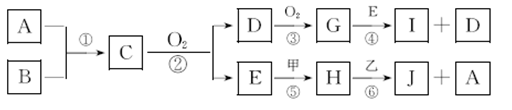
图10-3
(1)写出反应②的化学方程式_______________。
(2)反应④中每消耗1 mol G,转移电子的物质的量为________。
(3)反应⑥的离子方程式是______________。
(4)写出工业冶炼金属乙的化学方程式________________。
(5)实验室中保存I的浓溶液的方法是______________。
(6)SiCl4与过量A在加热条件下反应可制得高纯硅,整个制备纯硅的过程中必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是_______________;H2还原SiCl4过程中若混入O2,可能引起的后果是________________。
(7)有一种常见金属丙,常温时只能溶于稀的I溶液,写出过量的此金属溶于稀I溶液的离子方程式___________,向此溶液中加入H溶液,现象为__________。
下图中各步反应的最后产物D是一种饱和一元醇,其蒸气的密度是相同状况下H2密度的23倍。试回答:
(1)结构简式:A________,D________;
(2)反应类型:⑥________,⑧________;
(3)写出化学反应方程式:④________,⑥________,⑦________,⑧________。
(8分)有一包白色固体混合物,该混合物可能含有CuSO4、Na2CO3、Na2SO4、MgCl2,现进行如下实验:
(1)将混合物溶于水,得到无色透明溶液。
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解;另一份滴加NaOH溶液,有白色沉淀生成。试根据实验现象推断,并完成下面的填空:
该混合物中肯定没有________和________;肯定含有________和________(写化学式)。
W、X、Y和Z都是周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物;
②Y和Z属同族元素,它们能形成两种常见化合物;
③X和Z属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。
请回答:
(1)W元素是______;Z元素是________。
(2)化合物WY和WX2的化学式分别是____________和 ____________。
(3)Y和Z形成的两种常见化合物的分子式是________和________。
(4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:___________
氧化还原反应的实质是___________;元素的化合价降低,发生的是__________反应;氧化还原反应中,还原剂_____________电子(填“得”或“失”);试写出Na 2 O 2 与H 2 O反应的化学方程式,并用双线桥标出电子转移的方向和数目: _____________。