(8分)有一包白色固体混合物,该混合物可能含有CuSO4、Na2CO3、Na2SO4、MgCl2,现进行如下实验:
(1)将混合物溶于水,得到无色透明溶液。
(2)取上述溶液分成两份盛于试管中,其中一份滴加BaCl2溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解;另一份滴加NaOH溶液,有白色沉淀生成。试根据实验现象推断,并完成下面的填空:
该混合物中肯定没有________和________;肯定含有________和________(写化学式)。
.下表是某食用碘盐包装袋上的部分说明:
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
请回答下列问题:
(1)下列说法正确的是。
A.碘酸钾易挥发 B.高温会导致碘的损失
C.用淀粉就能直接检验碘盐中的碘酸钾 D.碘酸钾可氧化氯化钠
(2)碘酸钾与碘化钾在酸性条件下发生如下反应:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),该化学方程式配平后系数依次为。
w.该反应的还原剂为;1mol KIO3完全反应转移的电子总数为。
(3)碘不能多也不能少。已知:I2+2S2O32-=2I-+S4O62-,我校化学兴趣小组测定某食用碘盐中碘的含量。其步骤为:
①准确称取w g食盐,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;③以淀粉为指示剂,逐滴加入物质的量浓度为1.0×11-3mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示)mg/kg。
A-H及X均为中学化学常见物质, X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。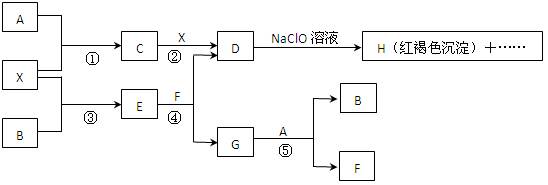
试回答下列问题:
(1)写出C物质的化学式 ;
(2)在上述①-⑤ 反应中肯定不属于氧化还原反应的是 (填编号);
反应中肯定不属于氧化还原反应的是 (填编号);
(3)指出元素X在元素周期表中的位置: ;
(4)请写出反应④和⑤的离子方程式:④ ,
⑤ ;
(5)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:
。
现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)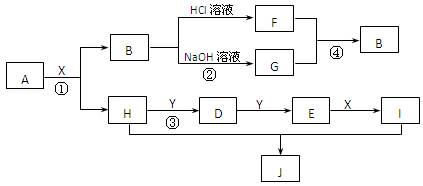
根据上述转化关系图回答:
(1)写出下列物质的化学式 X;J
(2)物质H的电子式:;
物质J属于哪种晶体类型: 。
。
(3)写出反应①的化学方程式;
写出反应④的离子方程式。
(共13分)有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物完全燃烧生成44.0g CO2和14.4g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的碳碳三键,核磁共振氢谱有三个峰,峰面积为6﹕1﹕1。
(1)A的分子式是;(2)A的结构简式是;
(3)下列物质中,一定条件能与A发生反应的是(填字母);
A.H2 B.Na C.KMnO4 D.Br2
(4)有机物B是A的同分异构体,1mol B可与1mol Br2加成。该有机物所有碳原子在同一个平面,没有顺反异构现象。则B的结构简式是。
(共15分)写出下列有机反应的化学方程式
(1)实验室制取乙炔:;
(2)2-溴丙烷与NaOH的醇溶液的反应:;
(3)向苯酚钠溶液中通入少量的CO2;;
(4)由甲苯制取TNT;;
(5)苯甲醇的催化氧化;。