周期表前20号元素中有A、B、C、D、E五种元素。已知它们都不是稀有气体元素且只有一种金属元素,且原子半径依次减小,其中除了A和E同族外其他都不同族,A与C、B与E原子的电子层数都相差2,A、B原子最外层电子数之比为1:4。
(1)写出元素符号:B D E
(2)A和C能以原子数1:1形成一种化合物,写出该化合物的化学式
钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛应用。
(1)将0.0lmol下列物质①Na2O2②Na2O③Na2CO3④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时其负极的电极反应式是__ __;
(3)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。请写出其反应的化学方程式__ __;
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是 ;
(5)钠一钾合金可在核反应堆中用作热交换液。5.05g钠一钾合金溶于200mL水生成0.075mol氢气。则该溶液中氢氧根离子的物质的量浓度是 ;(忽略溶液体积变化)。计算并确定该钠一钾合金的化学式为 (列出计算过程)
【化学——选修2:化学与技术】
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是()
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |
II、合成氨的流程示意图如下:
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;
(3)设备B的名称,其中m和n是两个通水口,入水口是(填“m”或“n”)。不宜从相反方向通水的原因;
(4)设备C的作用;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于。
CO2 (g)+ H2 (g),已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于。
甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
| 方法一 |
CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 |
CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g) |
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g)△H=-1275.6 kJ•mol-1
2CO2(g) + 4H2O(g)△H=-1275.6 kJ•mol-1
② 2CO(g) + O2(g)  2CO2(g)△H=-566.0 kJ•mol-1
2CO2(g)△H=-566.0 kJ•mol-1
③ H2O(l) = H2O(g)△H =" +" 44.0 kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为;已知该反应在低温下能自发进行,则反应的
△H为(填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K=。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①当左槽溶液逐渐由黄变蓝,其电极反应式为。
②充电过程中,右槽溶液颜色变化是。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为(法拉第常数F=9.65×l04C · mol-1)。
Ⅰ、按要求写出下列反应的方程式:
(1)碳酸氢铵与少量的氢氧化钠溶液反应(离子方程式)。
(2)氯化铁溶液中通入二氧化硫气体(离子方程式)。
(3)一定量的硫酸铝钾加入氢氧化钡溶液生成沉淀质量最大时的反应(化学方程式)。
(4)碘化亚铁和氯气以5:7的物质的量比反应(化学方程式)。
Ⅱ、已知Fe2O3在高炉中有下列反应:Fe2O3+CO=2FeO+CO2,反应形成的固体混合物(Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
(1)上述固体混合物中,m(Fe):m(O)可能是。
a.7:5b.3:1c.7:1
(2)设Fe2O3被CO还原的百分率为A%,则用含m(Fe)、m(O)的代数式表示A%的关系式为。
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5 kJ·mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) △H2 =-64.4 kJ·mol-1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+ Mg2NiH4(s)△H3,则△H3 = kJ·mol-1。
(2)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为。
(3)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为L。
(4)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是(填字母)。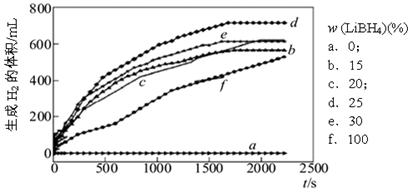
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w (LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。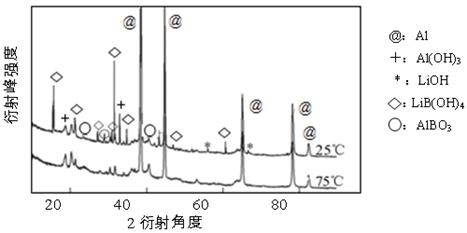
从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是(填化学式)。
(5)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: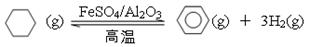
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为。