甲醇是一种可再生能源,又是一种重要的化工原料,具有开发和应用的广阔前景。工业上可用如下方法合成甲醇:
| 方法一 |
CO(g) +2H2(g)  CH3OH(g) CH3OH(g) |
| 方法二 |
CO2(g) +3H2(g)  CH3OH(g) H2O(g) CH3OH(g) H2O(g) |
(1)已知:① 2CH3OH(l) + 3O2(g)  2CO2(g) + 4H2O(g) △H=-1275.6 kJ•mol-1
2CO2(g) + 4H2O(g) △H=-1275.6 kJ•mol-1
② 2CO(g) + O2(g)  2CO2(g) △H=-566.0 kJ•mol-1
2CO2(g) △H=-566.0 kJ•mol-1
③ H2O(l) = H2O(g) △H =" +" 44.0 kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为 。
(2)方法一生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%。请回答下列问题:
①前5分钟内甲醇的平均反应速率为 ;已知该反应在低温下能自发进行,则反应的
△H为 (填“>”、“<”或 “=”)0。
②在该温度下反应的平衡常数K= 。
③某时刻向该平衡体系中加入CO、H2、CH3OH各0.2mol后,将使ν正 ν逆(填“>”“=”“<”)。
(3)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色变化是 。
③若用甲醇燃料电池作为电源对其充电时,若消耗甲醇4.8g时,电路中转移的电量的为 (法拉第常数F=9.65×l04C · mol-1)。
(本小题满分7分)
(1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难而易。有机化工厂附近严禁火种,这是因为绝大多数有机物。
(2)为了检验和除去下表中的各种物质中的杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
(I)检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶液C.盐酸D.氢氧化钠溶液
(II)除杂试剂:a. 无水硫酸铜 b.氢氧化钠溶液 c.新制的生石灰d.溴水
(本小题满分16分)
Ⅰ.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有(多选扣分)
a.开发氢能源 b.使用电动车 c.植树造林 d.戴上呼吸面具
Ⅱ.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,
B的最外层电子数比K层电子多1,
D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
(1) 指出元素A在周期表中的位置,其气态氢化物的化学式为。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号),
可以验证该结论的是(填写字母序号);
A.比较这两种元素的常见单质的熔沸点 B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序:。(填写化学式)
有下列晶体:①冰②金刚石③氩④过氧化钠⑤二氧化硅⑥氯化镁⑦纯醋酸⑧白磷⑨氯化铵⑩金属铝。用序号回答下列问题:
(1)在一定条件下能导电而不发生化学变化的是;
(2)只含有极性共价键的分子晶体是 ;
(3)固态时,晶体中只含有范德华力的是;
(4)含共价键的离子晶体是 ;
(5)只含有离子键的离子晶体是_______;
(6)只含有非极性键的原子晶体是_________;
I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中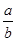 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:____________
(3)平衡时,N的转化率为。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。则燃烧1molH2放出的热量为kJ。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
已知A、B、C、D为气体,E、F为固体,G为CaCl2,它们之间的转化关系如下: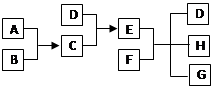
(1)D的结构式为, E的电子式为。
(2)用电子式表示A和B反应形成C的过程。
(3)E和F反应生成D、H和G的化学方程式,该反应的用途是。