化合物A在氢氧化钠溶液中加热反应后再酸化可生成B和C。
(1)B是邻位二取代的芳香族化合物,其分子式为C7H6O3。已知B遇FeCl3溶液显紫色,1 mol B与足量Na反应可生成1 mol H2。则B的结构简式为 。B与乙醇发生酯化反应生成X的化学方程式为 。
(2)C只由C、H、O三种元素组成。其相对分子质量在100~110之间,其中氧的质量分数约为60.4%。则C的分子式为 。
(3)已知1 mol C 最多可与1 mol NaHCO3或3 mol Na反应。C在一定条件下可以发生如下图所示的转化(其他产物和水已略去,已知同一个碳原子上连接两个羟基时不稳定,会自动脱水)。
①C中含氧官能团的名称为 。
②若C可以由乳酸 经过几步有机反应制得,其中最佳的次序是: 。
经过几步有机反应制得,其中最佳的次序是: 。
a.消去、加成、水解、酸化 b.氧化、加成、水解、酸化 c.取代、水解、氧化、酸化
③写出由C反应生成D的化学方程式: ,反应类型是 。
(4)X有多种同分异构体,写出其中满足以下条件的所有同分异构体 。
①能发生银镜反应且能水解; ②遇FeCl3溶液显紫色;
③苯环上只有两个侧链,且苯环上的一氯代物只有两种。
铝铵矾[NH4Al(SO4)2·12H2O]是一种重要的工业原料,将它溶于水配成溶液,然后逐滴滴入NaOH(aq),已知:NH +AlO
+AlO +H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
+H2O====Al(OH)3↓+NH3↑,写出先后发生反应的离子方程式:
(1),
(2),
(3)NH3·H2O NH3↑+H2O,
NH3↑+H2O,
(4)。
现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Ag+ Ba2+Al3+ |
| 阴离子 |
OH- Cl- SO42- |
为鉴别它们,分别完成以下实验,其结果是:
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加过量E溶液,沉淀是减少,但不消失。
请根据上述实验结果,填空:
⑴写出化合物的化学式:A , C,D, E 。
⑵A溶液与过量E溶液反应后,最终得到的沉淀的化学式是。
现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol。则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数为______个。
(3)该气体在标准状况下的体积为______L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为______。
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为______mol/L
从①盐析、②聚沉、③溶胶、④凝胶、⑤布朗运动、⑥电泳、⑦丁达尔效应、⑧中和、⑨水解中,选出适当的序号填入下列每小题后面的空格中:
(1)在浓肥皂水中加入饱和食盐水,肥皂凝聚,这种现象称为________。
(2)在肥皂水中透过强光,可见到光带,这种现象称为________。
(3)在肥皂水中加入酚酞变为红色,说明高级脂肪酸根离子发生了____________。
(4)在Fe(OH)3胶体中加入(NH4)2SO4,产生红褐色沉淀,这种现象叫做______________。
(5)在水泥厂和冶金厂常用高压电对气溶胶作用,除去大量烟尘,以减小对空气的污染。这种做法应用的主要原理是___________________________________________________。
.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)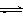 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。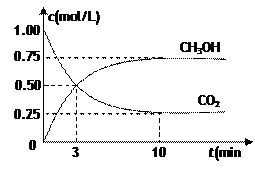

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
(2)该条件下的平衡常数为__________________。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol CO2和3mol H2 |
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。