汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒 气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 |
B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
(2)该反应达到平衡时若增大压强,则混合气体的 平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).t1:增大NO的浓度 t2:降低温度
(4)判断该条件下反应能否自发.
有一化学反应aA+bB=C,根据影响化学反应速率的因素可得vC=k{c(A)}m{c(B)}n。其中k是与温度有关的常数,为测k、m、n的值,在298 K时,将A、B溶液按不同的浓度混合,得到下列实验数据:
(1)根据上表可求得:m=_______,n=______,k=________,k的单位是_______。
(2)用B表示的初始反应速率为___________________。
现将0.40 mol A气体和0.20 mol B气体充入10 L的密闭容器中,在一定条件下使其发生反应生成气体C,其物质的量的变化如图: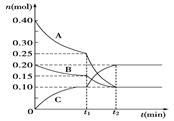
(1)若t1=10 min,则0至t1时间内C物质的平均反应速率为____________;该反应在t2时达到平衡,其化学方程式为__________________________。
(2)据图中曲线变化情况分析,t1时刻改变的反应条件可能是_____ ___。
| A.加入了催化剂 | B.降低了反应温度 |
| C.向容器中充入了C | D.缩小了容器体积 |
(6分)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:
| 化学键 |
N—H |
N—N |
O==O |
N≡N |
O—H |
| 键能(kJ/mol) |
386 |
167 |
498 |
946 |
460 |
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1 mol肼完全燃烧时放出的热量为________.
(2)为了提高肼(N2H4)燃烧过程中释放的能量,常用二氧化氮作氧化剂代替氧气,这两者反应生成氮气和水蒸气.且:
①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol
②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol
试写出肼和NO2完全反应的热化学方程式:____________________________________
(3)随着中国空间技术的发展,中俄于2009年携手探火星工程,寻找更高效的火箭推进剂也被提到了议事日程.在实验室我国科研人员应用电子计算机模拟出具有高能量的物质N60,它的结构与C60十分相似.已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有________个N—N键.
A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子分别位于IA , IIIA , VIA族且同周期,B对应碱呈两性,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B,C,D,E
(2)写A与E两元素可形成化合物的电子式:。
(3)写出A、B两元素的最高价氧化物的水化物之间的相互反应的化学方程式:
。
(4) 比较C、D的最高价氧化物的水化物的酸性的强弱:。(用化学式表示)
甲、乙、丙、丁是四种短周期元素,乙原子有三个电子层,第一层与最外层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲是元素(填元素符号),甲的单质与水反应的化学方程式为
;
(2)乙是元素(填元素符号),原子结构示意图为;
(3)丙是元素(填元素名称),最高价氧化物对应水化物的化学式是;
(4)丁是元素(填元素名称),甲与丁两种元素可组成的物质有、。(填化学式)