氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)。
(2)加入MgO的作用是 ;滤渣的主要成分为 。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;② ;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-): ;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数) 。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:。
(2)为了证明溴乙烷中含有溴元素,下列操作的正确顺序是(填序号)。
①滴加AgNO3溶液②充分振荡、静置③取上层水溶液④加入5%的NaOH溶液
⑤滴加过量稀HNO3。
滴加AgNO3溶液时发生反应的离子方程式是。
(3)菱铁矿的主要成分为FeCO3。将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。写出这一变化过程的离子方程式。
【化学----选修有机化学基础】
合成肉桂酸异戊酯G( )的路线如下:
)的路线如下:
友情提示:
①B和C含有相同的官能团且C在标准状况下的气体密度为1.964g/L;
② 。
。
回答下列问题:
(1)A的结构简式为,D中含有的官能团的名称是;
(2)下列物质在一定条件下能与F反应的是(填标号);
A.溴水 B.酸性KMnO4溶液 C.乙酸 D.新制氢氧化铜的悬浊液
(3)B和C反应生成D的化学方程式为。
(4)E和F反应生成G的化学方程式为,
反应类型为。
(5)A的同分异构体中含有苯环的共有种(不考虑立体异构且包括A),其中与氯化铁不能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的为____(写结构简式)。
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是,非金属性最强的是;(填元素符号)
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是;(用化学式表示)
(3)甲和乙形成的化合物的中心原子的杂化类型为;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为;
(4)除乙外,上述元素的电负性从大到小依次为;(填元素符号)
(5)单质戊与水反应的离子方程式为
(6) 一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应, 则产物为,(用化学式表示)其物质的量之比为。
【化学——选修化学与技术】
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: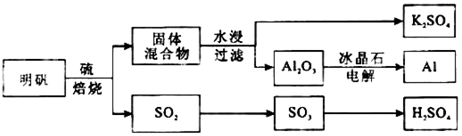
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是;
(2)从水浸后的滤液中得到K2SO4晶体的方法是;
(3)A12O3在一定条件下可制得AIN,其晶体结构如图所示,该晶体中Al的配位数是;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新
型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程
式是;
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= 一197 kJ/mol;
2SO3(g)△H1= 一197 kJ/mol;
2H2O (g)=2H2O(1)△H2=一44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545 kJ/mol。
则SO3 (g)与H2O(l)反应的热化学方程式是;
(6)焙烧948吨明矾(M=474 g/mol ),若SO2的利用率为96%,可生产质量分数为98%的硫
酸吨。
(14分,每空2分)
某中学的化学兴趣小组对SO2与漂白粉的反应进行实验探究,实验过程如下:取10克漂白粉固体,加入250mL水中,部分固体溶解溶液略有颜色,过滤后用洁净的玻璃棒沾取滤液到pH试纸上,发现pH试纸先变蓝(约为12)后褪色.回答下列问题:
(1)工业制取漂白粉的化学方程式是 __,
漂白粉在空气中变质的原因(用化学反应方程式说明)
(2)pH试纸颜色的变化说明漂白粉溶液具有的性质是,ClO2和漂白粉一样也具有强氧化性,其消毒效率(以单位物质的量得电子的数目表示)是Cl2的倍;
(3)将SO2持续通入漂白粉溶液中,发现澄清透明的溶液先变为黄绿色,随后溶液中产生大量白色沉淀且黄绿色褪去。回答下列问题:
①澄清透明溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂白粉的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是;
②用离子方程式解释现象中黄绿色褪去的原因:;
③SO2与漂白粉的有效成分在酸性条件下反应的离子方程式:。