一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
某学生的实验过程和具体操作可简述如下:
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率 (用小数表示,保留二位小数)。
已知T℃、P kPa时,在容积为V L密闭容器内充有1 mol A和1 mol B.保持恒温恒压,使反应:A(g)+B(g)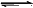 C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)达到平衡时,C的体积分数为40%。试回答有关问题:
(1)欲使温度和压强在上述条件下恒定不变,在密闭容器内充入2 mol C,则反应达到平衡时,容器的容积为___________,C的体积分数为_________。
(2)若另选一容积固定不变的密闭容器,仍控制温度为T℃,使1 mol A和1 mol B反应达到平衡状态时,C的体积分数仍为40%,则该密闭容器的容积为_________。
(共10分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其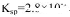 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 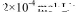 ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。
(3)己知:BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=+571.2kJ/mol
BaSO4(s)+2C(s)=4CO2(g)+BaS(s)△H2=+226.2kJ/mol
则反应c(s)+CO2(g)=2CO(g)的△H3=___________kJ/mol。
将一定量的铜粉加入100 mL浓硫酸中,加热发生反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,充分反应后放出13.44 L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500 mL。请按要求回答下列问题:
CuSO4+SO2↑+2H2O,充分反应后放出13.44 L(标准状况下)气体,固体有剩余,将反应后的溶液加水稀释至500 mL。请按要求回答下列问题:
(1)请用双线桥法分析该反应:。
(2)浓硫酸在该反应中的作用是和。
(3)反应后Cu2+的物质的量浓度为多少?(简要写出计算过程)
已知:
(Ⅰ)A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平。
(Ⅱ)2CH3CHO+O2 2CH3COOH
2CH3COOH
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构式。
(2)B、D所含官能团的名称分别是和。
(3)写出下列反应方程式及反应类型:
①方程式,反应类型。
②方程式,反应类型。
④方程式,反应类型。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为:。
(2)反应开始至2min,用Z表示的平均反应速率为:。
(3)下列叙述能说明上述反应达到化学平衡状态的是(填序号)
| A.混合气体的总物质的量不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2 mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g) 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率。