某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
(1)该反应的化学方程式为: 。
(2)反应开始至2min,用Z表示的平均反应速率为: 。
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填序号)
| A.混合气体的总物质的量不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内每消耗3mol X,同时生成2 mol Z |
| D.混合气体的总质量不随时间的变化而变化 |
E.恒定容积,混合气体的密度不再发生改变
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g) 2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”)
①升高温度,反应速率 ;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率 。
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:
反应器中主要发生的反应为:
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2ΔNa2SiO3+CO2↑
Ⅲ.Al2O3+2NaOHΔ2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245g KClO3参加反应,则转移的电子数为_____________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式_____________________________
___________________________。
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为__________________________,离子方程式为_______________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾__________(填字母)
A.重结晶B.萃取分液C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式________________________。
肉桂酸异丁酯 是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精。其中一种合成路线如下:
是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精。其中一种合成路线如下:
已知以下信息:
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为_______________,其中含氧官能团的名称为_____________。
(2)B能与新制的Cu(OH)2悬浊液发生反应,该反应的化学方程式为_____________。
(3)E和F反应生成G的化学方程式为_______________________________________,反应类型为____________________。
(4)F的同分异构体中不能与金属钠反应生成氢气的有机物共有_________种(不考虑立体异构),其中一种同分异构体H的核磁共振氢谱只有两组峰,且峰面积比为3:2的是(写结构简式),此种物质可经过流程: 制得,写出
制得,写出 反应的化学方程式:_________________________________ 。
反应的化学方程式:_________________________________ 。
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为__________________。
(2)氮所在主族中第一电离能最大的元素是___________(填元素符号,下同),镓所在主族中电负性最大的元素是_____________________。
(3)传统的氮化镓制备方法是采用CaCl3与NH3在一定条件下反应,该反应的化学方程式为_________________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以__________相结合,氮化镓属于______________晶体。
(5)下图是氮化镓的晶胞模型:
①氮化镓中镓原子的杂化方式为_______________,氮原子的配位数为__________________。
②氮化镓为立方晶胞,氮化镓的密度为 。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
锌锰干电池所含的汞、酸或碱等在废弃后进入环境中将造成严重危害。对废旧电池进行资源化处理显得非常重要。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为_________________________________________________________。
(2)填充物用60℃温水溶解,目的是加快溶解速率,但必须控制温度不能太高,其原因是___________。
(3)操作A的名称为_____________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有___________mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:________________。
(5)铜帽溶解时加入H2O2的目的是_______________________________(用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是__________________________________________________.
②在强酸性环境下Hg的吸收率高的原因可能是_____________________________________.
乙醇是一种可燃性液体,按一定比例混合的乙醇汽油是一种新型清洁车用燃料,某科研机构研究利用CO2合成乙醇的方法:
(i)2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH1
CH3CH2OH(g)+3H2O(g) ΔH1
原料气氢气
(ii)CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH2
CO(g)+3H2(g) ΔH2
回答下列问题:
(1)使用乙醇汽油(汽油用戊烷代替)燃料时.气缸工作时进行的反应较多,写出燃烧产生有毒气体CO、NO的所有反应的化学方程式:________________________。
(2)反应(i)中能够提高氢气转化率的措施有____。
| A.增大压强 | B.加催化剂 | C.增大CO2的浓度 | D.及时分离体系中的乙醇 |
(3)利用CO合成乙醇是目前工业生产较为成熟的工艺。已知下列热化学方程式:
(iii)CO(g)+H2O(g)  CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
写出以CO(g)与H2(g)为原料合成乙醇的热化学方程式:___________________(焓变用 H1、
H1、 H3表示)。
H3表示)。
(4)反应(ii)中的甲烷和水蒸气是在特定的催化剂表面上进行的,该反应在不同温度下的化学平衡常数如下表: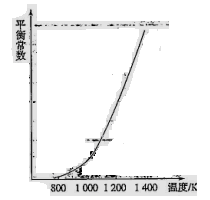
由此推知反应(ii)的焓变 H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
H2________0(填“>”、“=”或“<”)。某温度下,向容积为1 L的密闭容器中加入1 mol甲烷和1mol水蒸气,经过5h反应达到平衡状态,此时测得CH4的浓度变为0.5 mol/L。该温度下,反应(ii)的平衡常数K=__________________,反应开始至达到平衡时氢气的反应速率v(H2)=_________。
(5)机动车在改用乙醇汽油后,并不能减少氮氧化物的排放。使用合适的催化剂可使NO转化为氮气,实验测得NO转化为氮气的转化率随温度变化曲线如下图所示:
由图像可知,在没有CO情况下,温度超过775K,NO的转化率减小,造成这种现象的原因可能是___________________________;在NO和CO物质的量之比为1:1的情况下,应控制的最佳温度为__________________左右。