如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为 ;
②乙中总反应的离子方程式为 ;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为: ;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为: ;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入 (填写物质的化学式) g。
近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。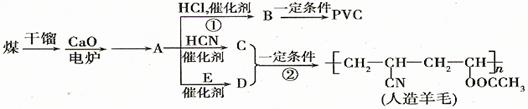
请回答下列问题:
(1)写出反应类型:反应①反应②。
(2)写出结构简式:PVC C。
(3)写出A D的化学反应方程式。
D的化学反应方程式。
(4)与D互为同分异构体且可发生碱性水解的物质有种(不包括环状化合物),
写出其中一种的结构简式。
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是(填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是(填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。、(不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液碘水
所选试剂为。
证明炉渣中含有FeO的实验现象为。
下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是。A、B、C、D四个容器中的反应,属于氧化还原反应的是(填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)=2NO(g)△H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式:,氨催化氧化反应的化学平衡常数表达式K=。
(3)已知:N2(g)+3H2(g) 2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
2NH3(g) △H= 一92 kJ/mol。为提高氢气的转化率,宜采取的措施有。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率
为。
由铜、银和硝酸银溶液组成的原电池中,负极反应式为,正极反应式为。
在一个小烧杯里,加入20g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后加入10gNH4Cl晶体,并立即用玻璃棒搅拌。
(1)试验中玻璃棒的作用是。
(2)写出有关反应的化学方程式,该反应属于反应。
(3)实验中观察到的现象有和反应混合物成糊状。反应混合物呈糊状的原因是。
(4)通过现象,说明该反应为热反应,这是由于反应物的总能量生成物的总能量。