某溶液含Cl-、SO42-、CO32-三种阴离子,欲依次检验出此三种阴离子且只取用一次该溶液,则:
(1)最先检出的离子是 ,需加入稍过量的试剂是 (写化学式);
(2)最后检出的离子是 ,反应的离子方程式为 。
(12分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式(不考虑同一碳原子上连两个羟基),并回答相关问题:
(1)甲分子中没有甲基,且1 mol甲与足量金属Na反应生成1 mol H2,还能与NaHCO3溶液反应,则甲的结构简式为 ,该物质 溶于水(填“难”或“易”), 原因是 ,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是 。
(2)乙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且乙与金属Na不反应,则乙结构简式为 ,该物质属于 类化合物(填“醇”、“醛”、“羧酸”或“酯”),它的液体密度应比水 。
下图所示为某些有机物之间的相互转化关系,其中A、B属于芳香族化合物,且B不能与FeCl3溶液发生显色反应,H是衡量一个国家石油化工发展水平标志的物质。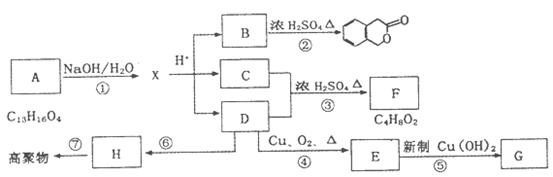
请回答下列问题:
(1)写出下列化合物的结构简式;
G __________________________ B__________________________
(2)写出下列反应类型:①_____________⑥______________
(3)写出反应①、④的化学方程式:
①_________________________________________________________________
④_________________________________________________________________
(4)符合下列3个条件的B的同分异构体的数目有________个。
①含有邻二取代苯环结构②与B有相同官能团③不与FeCl3溶液发生显色反应写出其中任意一个同分异构体的结构简式 __________________________。
某烃A的相对分子质量为84。回答下列问题:
(1)物质的量相同,下列物质充分燃烧与A消耗氧气的量不相等的是(填序号)_____________ 。
| A.C7H12O2 | B.C6H14 | C.C6H14O | D.C7H14O3 |
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为_____________。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_____________.
如图是用于简单有机化合物的制备、分离、性质比较等的常见简易装置。请
根据该装置回答下列问题: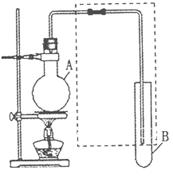
(1)若用乙醇与乙酸反应制取乙酸乙酯,则烧瓶A
中加入的试剂在混合时的操作方法是___________,反
应的化学方程式为___________ ,试管B中应
加入___________ 。虚线框中的导管除用于导气
外,还兼有___________ 作用。
(2)若用该装置分离乙酸和1-丙醇,则在烧瓶A
中除加入1-丙醇与乙酸外,还应先加入适量的试剂
___________,加热到一定温度,试管B中收集到的是(填写化学式)___________。冷却后,再向烧瓶中加入试剂___________再加热到一定温度,试管B中收集到的是___________(填写化学式)。
若用该装置(不用加热)证明酸性:醋酸>碳酸>苯酚,则在烧瓶A中加入___________ ,试管B中应加入___________。
下列物质是几种常见香精的主要成分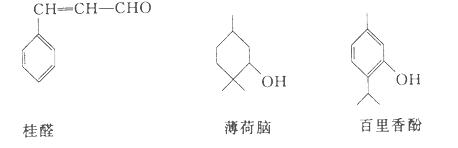
(1)薄荷脑的分子式为___________.
(2)鉴别薄荷脑和百里香酚,可选用的试剂是___________。
(3)下列对于桂醛的说法不正确的是___________ 。
| A.可发生加聚反应 | B.可发生取代反应 |
| C.可发生氧化反应 | D.最多可与2 molH2发生加成反应 |
(4)写出百里香酚与足量浓溴水反应的化学方程式:
__________________________________________________________________.
(5)写出往百里香酚钠溶液中通入CO2气体的化学反应方程式:
__________________________________________________________________.