(15分)已知2A(g)+B(g)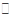 2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
2C(g),H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后C的浓度为ω mol/L,放出热量为b kJ。
⑴比较a b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 T2(填“>”、“=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 (填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 (用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。
A. 4 mol A和2 mol B B. 4 mol A、2 mol B和2 mol C
C. 4 mol A和4 mol B D. 6 mol A和4 mol B
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出热量为d kJ,则d b(填“>”、“=”或“<”),理由是_ 。
⑹ 在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,使之反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量 (填“不变”、“变大”、“变小”或“无法确定”)。
请回答下列问题:
(1)有机物M经过太阳光光照可转化为N,转化过程如下: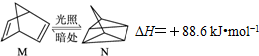
则M、N相比,较稳定的是 _________
(2)25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为_______mol/L
(3)已知CH3OH的燃烧热△H= -akJ•mol-1,CH3OH(l)+1/2O2(g)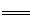 CO2(g)+2H2(g)△H= -bkJ•mol-1,则a_____b(填“>”、“<”或“=”)。
CO2(g)+2H2(g)△H= -bkJ•mol-1,则a_____b(填“>”、“<”或“=”)。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:_____________________________。
现有五种有机物:乙烯、乙醇、乙酸、乙酸乙酯、苯。
(1)请分别写出其中含有以下官能团的有机物的名称:
①醇羟基_________;②—COOH____________。
(2)在上述五种有机物中(填写序号)
①既能发生加成反应,又能发生聚合反应的是_____________。
②能发生水解反应的是_______________。
(3)把苯加入到盛有溴水的试管中,液体会出现分层现象,充分振荡、静置,出现橙红色液体的一层在__________(填“上”或“下”)。
(4)把苯加入到盛有少量酸性高锰酸钾溶液的试管中,振荡后,酸性高锰酸钾溶液不褪色,说明苯分子中_________(填“有”或“没有”)碳碳双键。
现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵,⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号) 。
(3)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是 。
(4)已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将________(填“增大”、“减小”或“无法确定”)。
的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”,下同)
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,工业上合成氨反应通常用铁触媒作催化剂,反应方程式为:N2+3H2 2NH3 △H<0。
2NH3 △H<0。
(1)已知N2(g)+3H2(g)  2NH3(g)ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
2NH3(g)ΔH=-92kJ·mol-1,拆开1mol H-H键,1molN≡N键分别需要的能量是436kJ、、946kJ,则拆开1molN-H键需要的能量是__________。
(2)合成氨反应达到平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
| A.c(H2)减小 | B.正反应速率加快,逆反应速率减慢 |
| C.NH3的物质的量增加 | D.平衡常数K增大 |
E.平衡向正方向移动
(3) 如图2所示,在甲、乙两容器中分别充入1molN2和3molH2,使甲、乙两容器初始容积相等。在相同温度下发生反应N2(g)+3H2(g)  2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。
2NH3(g) ,并维持反应过程中温度不变。已知甲容器中H2的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中H2的转化率随时间变化的图像。

(4)若反应N2(g)+3H2(g)  2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。
2NH3(g)在一容积固定不变的容器内进行,并维持反应过程中温度不变。若平衡从正向建立,且起始时N2与H2的物质的量分别为amol、bmol,当a:b=______时,达到平衡后NH3的体积分数最大。