(17分)金属镍具有优良的物理和化学特性,是高技术产业的重要原料。
(1)羰基法提纯镍涉及的反应为:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①当温度升高时,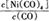 减小,则H 0(填“>”或“<”)。
减小,则H 0(填“>”或“<”)。
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________(填代号)。
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0—3s内的平均反应速率v(CO)=____mol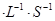 。
。
③要提高上述反应中CO的转化率,同时增大反应速率,可采取的措施为____________________(写出一条措施即可)。
(2)以NiS04溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是____________(填代号)。(已知氧化性: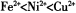 )
)
a.电解过程中,化学能转化为电能
b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属
d.粗镍精炼时通过的电量与阴极析出镍的质量成正比
(3)工业上用硫化镍(NiS)作为电极材料冶炼镍。电解时,硫化镍中的硫元素以单质形态沉积在某电极附近,镍元素以Ni2+形态进入电解液中,如图所示。硫化镍与电源的____________(填“正极”或“负极”)相接。写出阳极的电极反应式________________。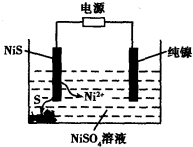
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。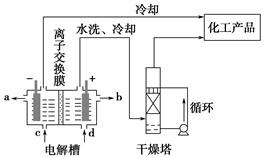
(1)上图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是________;NaOH溶液的出口为________(填字母);精制饱和食盐水的进口为________(填字母);干燥塔中应使用的液体是________。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
①SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________________________________。
②SiCl4可转化为SiHCl3而循环使用,一定条件下,在20 L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2和SiHCl3物质的量浓度分别为0.140 mol/L和0.020 mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为________kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0 kg,则生成氢气________m3(标准状况)。
我们的生活、学习离不开物质,其中很多物质是通过工业生产而得到的。请回答下列问题:
(1)生活用水是来自于自来水公司的管道水,其来源有两个:地表水和地下水。地表水中往往含有悬浮物和胶体,自来水厂需要对地表水进行________处理;地下水中往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行__________处理。
(2)有限的土地,要提高粮食产量,离不开科学技术,离不开化学肥料的合理使用。铵态氮肥中的“铵”的生产原料为________,该物质在工业生产中使用的条件是__________________________________。
(3)患有近视的同学学习离不开眼镜,眼镜片有玻璃和合成树脂的。其中易碎的镜片材料是__________,镜片有灰尘不能用酒精擦拭的是__________。
(4)厨房中离不开食盐,该物质主要来自于海水,写出一种用海水制备食盐的方法____________,工业上可用食盐制备纯碱,食盐的作用是________________________。
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要__________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: ______________________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有____________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是__________。
a.熔点较低(29 ℃熔化) b.能导电
c.能制冷d.无毒
(5)上述工艺流程中体现的绿色化学理念是____________________________
材料一 DDT是20世纪60年代以前广为应用的一种杀虫剂,它由三氯乙醛和氯苯通过如下反应制备得到: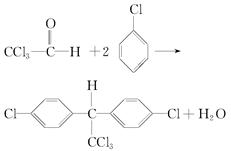
据统计,由于使用了DDT等化学农药,减少了病虫害,挽回的粮食损失占总产量的15%。若以世界粮食产量18亿吨计算,那么有2.7亿吨是由化学农药换回来的,相当于10多亿人一年的口粮。此外,DDT还能有效地杀灭蚊蝇、体虱等传播疾病的害虫,从而大大减少疟疾、伤寒等的发病率和死亡人数。瑞士昆虫学家保罗·米勒因发现DDT药效,而于1948年荣获诺贝尔生理医学奖。
材料二 DDT曾因其稳定性、脂溶性、药效普适性等特点被大量生产和普遍使用,以致造成很大的环境污染。美国生物学家卡尔松曾对包括DDT在内的医药所造成的公害,做过生动的描写:“天空无飞鸟,河中无鱼虾,成群鸡鸭牛羊病倒和死亡,果树开花但不能结果,农夫诉说着莫名其妙的疾病接踵袭来。总之,生机勃勃的田野和农庄变得一片寂静,死亡之幽灵到处游荡……”此发现引起社会强烈反响。从20世纪70年代初起,美国、瑞士等国相继禁止生产DDT。我国政府于1985年禁止使用DDT。
材料三 为了杀灭对人类有害的昆虫,而又避免或减少污染环境和破坏生态平衡。化学工作者进行了不懈地努力,研制出多种新型杀虫剂,以代替DDT等农药。例如,化合物A就是其中一种,其结构简式如图所示。
请完成下列各题。
(1)氯苯是一种重要的化工原料,由氯苯和三氯乙醛生产DDT的反应是__________。
A.化合反应B.分解反应C.取代反应D.加成反应
(2)下列关于DDT的说法中,不正确的是__________。
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
(3)在过去,施用农药DDT的地区虽然占陆地面积的一小部分,可是在远离施药地区的南极的动物体内也发现了DDT,在喜马拉雅山山峰的积雪中也发现了DDT,这种现象说明________。
A.DDT是挥发性物质
B.DDT已加入全球性的生物循环
C.考察队将DDT带到了南极
D.南极动物也偶尔到施用农药的地区觅食
(4)①化合物A的分子式为__________;
②化合物A可能有的化学性质________。
A.取代反应 B.加成反应 C.氧化反应 D.还原反应
E.酯化反应 F.水解反应
使用抗生素是治疗甲型H1N1流感的有效方法。青霉素的结构简式为: (R不同可形成不同的青霉素),本次治疗甲型H1N1流感,使用的五种青霉素所对应R的结构简式如下:
(R不同可形成不同的青霉素),本次治疗甲型H1N1流感,使用的五种青霉素所对应R的结构简式如下:
| 青霉素 |
—R |
| A |
CH3CH2CH=CHCH2CH2— |
| B |
 |
| C |
CH3—(CH2)4— |
| D |
CH3CH=CH—C(CH3)2— |
| E |
CH3—(CH2)6— |
根据表中五种青霉素回答下列问题:
(1)青霉素E的分子式________。
(2)属于同分异构体的是________,属于同系物的是________。
(3)已知蛋白质在酸性或碱性条件下都能水解,青霉素D分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量之比为________。
(4)青霉素A、B中的—R连接得到有机物F。对该有机物F的说法中不正确的是( )。
A.该有机物能使溴水和酸性KMnO4溶液褪色
B.该有机物可在一定条件下生成醇类
C.该有机物燃烧一定生成CO2和H2O
D.1 mol该有机物最多能与4 mol H2发生加成反应