按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A原子只有一个电子层且只含1个电子;B原子的3p轨道上得到1个电子后不能再容纳外来电子;C原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四电子层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5种):_______________________。
(2)写出由上述元素组成的物质制得A的单质的化学方程式(至少写出2个):_______________________、___________________________。
(3)检验某溶液中是否含有D+,可通过_______反应来实现;检验某溶液中是否含有B-,通常所用的试剂是_____________和________________。
(4)写出E的元素符号______________。
(14分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素是________;Y元素是________;Z元素是:________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。
电子层数相同的元素随着原子序数的递增,原子半径依次_______,核电荷数依次______,(填增加或减少)核对最外层电子的引力依次______,原子失去电子的能力逐渐______,得电子的能力逐渐_____,所以金属性依次_______,非金属性依次__________。
(填增强或减弱)
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
(1)写出A的电子式_____________。
(2)将X通入水玻璃溶液中,写出反应的离子方程式___________。
(3)自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(4)写出区分B、C溶液的一种实验方案
(4分)已知X和Y是短周期元素中的不同族单质,W、V是化合物,他们有如下反应(式中各物质的系数,反应条件均略去): X+W  Y+V
Y+V
试写出符合上述题意并满足下列要求的化学方程式:
(1)Y是IA族的单质;
(2)Y是IVA族的单质。
(10分)含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4这4种常见的含硫化合物。回答下列问题:
(1)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2 。写出该反应的化学方程式:。
(2)亚硫酸钠和碘酸钾在酸性溶液中发生以下反应: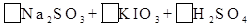 —
— 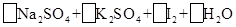
①配平上面的氧化还原反应方程式.将化学计量数填入方框中。
②其中氧化剂是,若反应中有5 mol电子转移,则生成的碘单质是mol。
(3) 向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成。此沉淀是
| A.BaSO4 | B.FeS | C.BaSO3 | D.S |
(4)常温下,将铁棒置于浓硫酸中.无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化