到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为 ▲ 。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)="CO(g) " ΔH = ▲ 。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
| 化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
| N≡N |
942 |
H-O |
460 |
| N-H |
391 |
O=O |
499 |
| H-H |
437 |
|
|
反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值 ▲ 。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值 ▲ 。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式 ▲ 。
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程。请回答下列问题:
(1)在大试管中需加入浓硫酸、冰醋酸各2mL,乙醇3mL,加入试剂的正确的操作是。
(2)浓硫酸的作用是:①;②。
(3)饱和碳酸钠溶液的主要作用是。
(4)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的,长导管的作用是。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是。
(6)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是。
(7)试管乙中观察到的现象是_______________ _____,由此可见,乙酸乙酯的密度比水________(填“大”或“小”),而且______。
(8)写出甲中发生反应的化学方程式:
(7分)某有机物的结构简式为HOOC—CH=CHCH2OH。
①请你写出该有机物官能团的名称:、 、。
②验证该有机物中含有-COOH官能团常采用的方法,产生的现象为。
③请你写出该有机物与氢气反应的化学方程式:
在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4②12C和 14C③ K和
K和  Ca④甲烷与丙烷
Ca④甲烷与丙烷
⑤异戊烷( )和新戊烷(
)和新戊烷( )
)
⑥ 和
和
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
(1)互为同位素的是;
(2)互为同分异构体的是;
(3)互为同系物的是;
(4)为同一种物质的是。
(8分)请同学们根据官能团的不同对下列有机物进行分类。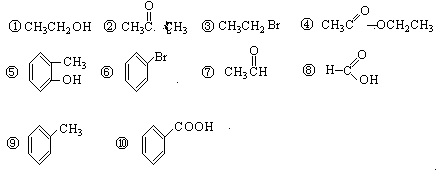
(1)芳香烃:;(2)卤代烃:;(3)醇:;(4)酚:;
(5)醛:;(6)酮:;(7)羧酸:;(8)酯:。
(10分)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g),ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
2NO(g),ΔH>0,已知该反应在2 404℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率为_____________________。
(2)为了减少汽车尾气中有害气体的排放,在现实生活中你认为可以采取的措施有。
| A.采用耐高温的陶瓷发动机,以提高内燃机的工作温度 |
| B.为了避免上述反应,不使用空气,改用纯氧气 |
| C.在排气管中安装高效催化剂,将有害气体转化为无害气体 |
| D.将燃油车改换成电动车 |
(3)将一定量的N2、O2的混合气体充入恒容密闭容器中,下图变化趋势正确的是____________(填字母序号)。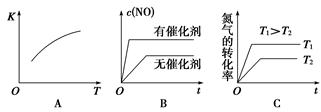
(4)将一定量的N2、O2的混合气体充入恒温密闭容器中,分别在不同的压强P1、P2(P1>P2)下达到平衡,请画出N2的转化率在不同压强下随时间变化的曲线图。(不同压强下的曲线要有相应的标识)