(1)可正确表示原子轨道的是: 。
| A.2s | B.2d | C.3p | D.3f |
(2)镓(Ga)原子序数为 ,写出其基态原子的电子排布式: 。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。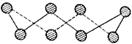
(4)用“>” “< ” “=” 填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
(5)NO3-的空间构型为 (用文字描述)。
(6)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 。CO与N2结构相似,CO分子内σ键与π键个数之比为 。
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为﹣96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式为 。
(2)CH3COCH3分子中含有个π键,含有个δ键。
(3)固态氯化铬酰属于晶体,丙酮中碳原子的杂化方式为,二硫化碳属于(填极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有有键。
(5)金属铬的晶胞如下图所示,一个晶胞中含有个铬原子。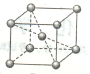
我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是,目的是除去铁矿石中的脉石,其产物密度比铁,所以在铁水的(填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是。
| A.作为燃料,为炼铁中的化学反应反应(删去)提供能量 |
| B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 |
| C.对高炉中的物料起到支撑和疏散的作用 |
| D.作为熔剂,除去铁矿石中的杂质 |
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有。
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:
。
碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s)  NH3(g) + HI(g)
NH3(g) + HI(g)
② 2HI(g)  H2(g) + I2(g)
H2(g) + I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色(填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = 。
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为极,电极反应式为。通电一段时间后,断开电源,振荡试管,上层溶液为色。
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是。
人民网西昌报道组10月1日电约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。

甲:嫦娥二号发射瞬间乙:运行中的嫦娥二号
已知A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子;bB与cC两种元素存在关系:b = c﹣1;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。
请解答下列问题:
(1)A元素在元素周期表第族中,D元素在元素周期表第周期中。
(2)B原子的原子结构示意图:。
(3)A、B两种元素形成的四原子分子的电子式为。
(4)上图甲中发生反应的化学方程式为:。
(5)A、B形成的六原子分子BA2—BA2也可以作为火箭发射中的燃烧剂,此时往往使用A、C形成的四原子分子(A2C2)作为氧化剂。已知8g BA2—BA2与足量A2C2反应,生成物均为无害气体,放出热量为160.35kJ。
请写出上述反应的热化学方程式:。
迷迭香酸(F)的结构简式为:
它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下: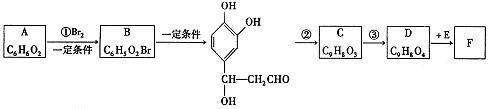
根据题意回答下列问题:
(1)写出结构简式:A;D。
(2)写出反应类型:反应①;反应②。
(3)反应③的试剂:____。
(4)lmol F分别与足量的溴水和NaOH溶液反应,最多可消耗Br2mol,NaOHmol。
(5)E在一定条件下发生缩聚反应的化学方程式是(已知苯环上羟基很难直接与羧酸发生酯化反应)。
(6)与E互为同分异构体,且同时满足下列条件的有机物有种。
①苯环上有四个取代基,且苯环上的一氯取代物只有一种。
②1mol该物质分别与NaHC03Na2C03反应时,最多消耗NaHCO3 Na2CO3的量分别是1mol和4mol。