(12分)【化学一物质结构与性质】
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程
式_______.
( 5)D2B的晶胞如图所示,已知晶体的密度为  ,阿伏加德罗常数为
,阿伏加德罗常数为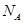 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、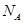 的式子表示)。
的式子表示)。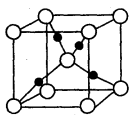
聚甲基丙烯酸酯纤维具有质轻、频率宽等特性,广泛应用于制作光导纤维。已知A为某种聚甲基丙烯酸酯纤维的单体,其转化关系如下:
(1)A的结构简式为。
(2)下列有关E的说法不正确的是(填写字母编号)
| A.能使酸性高锰酸钾溶液褪色 | B.能使溴的CCl4溶液褪色 |
| C.一定条件下,能够发生消去反应 | D.一定条件下,能够发生取代反应 |
(3)F的同分异构体中属于酯类的有种
(4)反应②的化学方程式是
反应⑤的化学方程式是
按要求完成下列问题:
(1)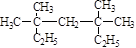 系统命名为 ;
系统命名为 ;
(2)4―甲基―1―戊烯的键线式为 。
(3)写出乙醛与新制氢氧化铜反应化学方程式;
(4)丙三醇与硝酸反应能生成三硝酸甘油酯,写出三硝酸甘油酯的结构简式
(5)下列有关实验的说法不正确的是_____________。
| A.制乙烯时,温度计应插入反应混合液中 |
| B.实验室用溴和苯在铁粉存在下反应,得到的溴苯显褐色,原因是溴苯在空气中被氧化 |
| C.检验C2H5Cl中氯元素时,将C2H5Cl和NaOH水溶液混合加热,然后用稀硫酸酸化,再加入AgNO3溶液 |
| D.做过银镜反应的试管用氨水洗涤,做过苯酚的试管用酒精洗涤 |
E.将一定量CuSO4和NaOH溶液混合后加入甲醛溶液,加热未产生砖红色沉淀,原因可能是NaOH量太少
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:。(填元素符号)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的化学式是:。
(3)比较①与⑤的最高价氧化物对应的水化物,的酸性强(填化学式);能通过说明(写反应的化学方程式)。
(4)实验室制取②的氢化物的化学方程式。
②的氢化物与②的最高价氧化物的水化物反应所得的产物化学式为。
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因(用化学方程式表示)。
(6)比较③与⑥的氢化物,更稳定(填化学式)。
(7)写出④的单质与水反应的离子方程式。
(8)写出⑦元素的离子结构示意图,该离子半径S2-(填“﹥”或“﹤”)写出⑩元素在周期表的位置。
有V、W、X、Y、Z五种元素,它们的核电荷数依次增大;且都小于20。其中只有X、Z是金属元素;V、Z元素原子最外层都只有一个电子;W、Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半.由此推知:
V是、W是、X是、Y是、Z是(填元素符号)
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1)+→+++H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为。