25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是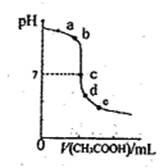
| A.水电离出的氢离子浓度:a>b |
| B.c点时恰好中和 |
| C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一) |
| D.e点时溶液中溶质是CH3COONa和CH3COOH |
向NaBr、NaI、Na2SO3混合溶液中,通入一定量的氯气后,将溶液蒸干并灼烧,得到的剩余固体的组成可能是( )
| A.NaCl Na2SO4 |
| B.NaCl NaBr Na2SO4 |
| C.NaCl Na2SO4 I2 |
| D.NaCl NaI Na2SO4 |
除去Na2CO3固体中少量NaHCO3的最佳方法是( )
| A.加入适量盐酸 |
| B.加入NaOH溶液 |
| C.加热 |
| D.配成溶液后通入CO2 |
氯化溴是由两种卤素互相结合而成的卤素化合物,其化学性质与Cl2相似,能与金属和非金属反应生成卤化物,能与水反应:BrCl+H2O====HBrO+HCl,下列有关BrCl的性质的叙述中不正确的是( )
| A.是较强的氧化剂 |
| B.是一种化合物 |
| C.能使湿润的淀粉碘化钾试纸变蓝 |
| D.BrCl与水反应,BrCl既是氧化剂又是还原剂 |
下图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
| A.浓H2SO4 |
| B.饱和NaCl溶液 |
| C.浓NaOH溶液 |
| D.浓NaBr溶液 |
不能用离子方程式: +2H+====CO2↑+H2O来表示的反应是
+2H+====CO2↑+H2O来表示的反应是
| A.碳酸钡和盐酸 |
| B.碳酸氢钾和H2SO4 |
| C.碳酸钠与硝酸 |
| D.碳酸铵与盐酸 |