【化学——物质结构与性质】
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
| A.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量 |
| B.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na |
| C.基态As原子中,电子占据的最高能级为4d |
| D.Bi原子中最外层有5个能量相同的电子 |
(2)NH3在水中的溶解度比PH3大得多,其原因是 。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有 和 。
(3)PCl3分子中,Cl-P-Cl键的键角____ 109o28’(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为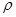 g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。
g·cm-3,晶胞的边长为acm,则阿伏加德罗常数为__ mol-l(用含ρ、a的式子表示)。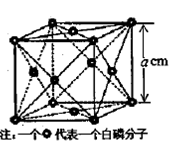
(8分)胃酸(主要成分为盐酸)过多是常见的胃病。甲、乙两种中学课本中用以治疗胃酸过多的常见胃药,以下是它们的说明摘要。
甲:(1)白色结晶状粉末,可缓缓分解;
(2)能溶于水,水溶液呈弱碱性;
(3)遇酸及酸性药物则产生二氧化碳;
乙:(1)与胃酸是中和作用缓慢而持久,可维持3~4小时。
(2)凝胶本身覆盖于溃疡面上,具有保护作用。
(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成份是(填中文名称);乙中含有的主要化学成份是(填化学式)。
(2)试写出甲中含有的主要化学成份引起胃胀气反应的化学方程式:。
(3)试写出乙中含有的主要化学成份分别与稀盐酸和氢氧化钠溶液反应的离子方程式:;。
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示: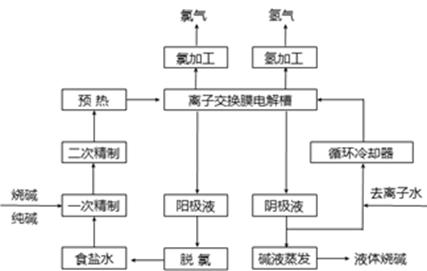
(1)该流程中可以循环的物质是。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式:,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果:。
(3)下图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是,E电极的名称是。电解总反应的离子方程式为。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为。
Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
30 |
| 总压强p/100 kPa |
4.56 |
5.14 |
5.87 |
6.30 |
7.24 |
8.16 |
8.18 |
8.20 |
8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l)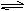 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。
试分析:
①B曲线代表(用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)=。
②M点,溶液中主要涉及的离子方程式:。
根据题给信息,完成下列各小题:
Ⅰ、某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为c(Na+)=4×10—4mol/L,c(SO42—)=2.5×10—4mol/L,c(Cl—)=1.6×10—5mol/L,c(NO3—)=1.4×10—5mol/L,c(Ca2+)=1.5×10—5mol/L,则该废水的pH为________。
Ⅱ、有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大;NaA溶液呈中性;1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC分别作导电性试验,发现后者的导电性比前者强,则这四种酸的酸性由强到弱的顺序为______________________。
Ⅲ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得
溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸__________(填“强酸”或“弱酸”);
(2)①组实验所得混合溶液中由水电离出的c(OH-)=__________mol·L-1。
(3)②组情况表明,c__________0.2 mol/L(选填“大于”、“小于”或“等于”)。
混合液中离子浓度c(A-)与c(Na+)的大小关系是___________。
(4)从③组实验结果分析,说明HA的电离程度__________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是__________。
(共10分前2个空每空一个1分,其余每空2分)、
依据氧化还原反应2Ag+(aq)+Cu(s) ="===" Cu2+(aq)+2Ag(s)设计的原电池如图所示: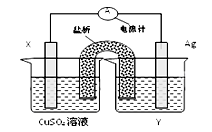
请回答下列问题:
(1)外电路中的电子是从_______ 电极流向________电极。
(2)银电极发生的电极反应为________________________;
X电极上发生的电极反应为____________________________;
(3)LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为4Li+2SOCl2==="4LiCl" +S +SO2↑。请回答下列问题:
写出电池的负极发生的电极反应为____________________________________;
电池正极发生的电极反应为____________________________________