(6分)为了探究复分解反应的实质,某兴趣小组同学对H2SO4与Ba(NO3)2的反应进行如下实验探究。
【提出问题】物质发生复分解反应时,是不是所有的离子都参加了反应。
【设计实验】
| 实验步骤 |
实验操作 |
实验现象 |
| 第一步 |
取一支洁净的试管,向其中加入一定量的稀硫酸溶液,再慢慢滴加Ba(NO3)2溶液至恰好完全反应。 |
|
| 第二步 |
在上述反应后的试管中再滴加3滴紫色石蕊试液。 |
试管中溶液由无色变成红色 |
(1)写出第一步发生反应的化学方程式 ;在上表中准确记录第一步实验操作时的现象。
【查阅资料】盐与酸和碱一样,溶于水之后也会发生解离成组成它的离子,如:Ba(NO3)2在水中会解离出Ba2+和NO3-。
【实验结论】(2)上述反应的实质是 和 (填离子符号)之间发生的反应。
【应用结论】(3)碳酸钾和澄清石灰水反应的实质是 和 (填离子符号)之间发生的反应,反应后的溶液中还存在大量的 离子,向反应后的溶液中滴加无色酚酞,溶液将变成 色。
(7分)小明在查阅资料时得知CO2在高温时能与木炭反应生成CO ,他决定对该反应进行探究。
【提出问题】CO2与木炭在高温条件下反应是否生成CO?
【实验探究】小明设计了下图的实验方案,并进行实验。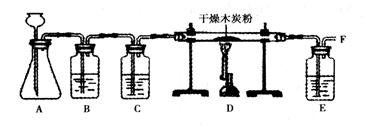
(1)A中用石灰石与稀盐酸反应的化学方程式为___________________。
(2)检查装置A气密性的方法是__________________________________________
(3)B中装有饱和碳酸氢钠溶液,其作用是除去CO2气体中混有的少量HCl气体。C中装有浓硫酸,其作用是__________________
(4)E中氢氧化钠溶液的作用是__________________。
【实验结论】经检验F处的气体为CO。结论:CO2在高温条件下与木炭反应生成了CO。
【实验反思】
有同学对A装置作如下改进:在锥形瓶中放入一小试管,将长颈漏斗下端插入小试管中,改进后的优点是_________________。
【实验拓展】
撤去B,按A→C→D→E顺序连接。然后A中用二氧化锰和过氧化氢溶液混合生成O2,反应的化学方程式为_________________。此时要检验该实验条件下D中木炭所发生反应的所有生成物,除在F处点燃并检验生成物外,还需要补充和完善的实验是________________。
(8分)实验室有一瓶标签受损的无色溶液,如下图所示。老师要求同学们进行探究:这瓶溶液到底是什么溶液?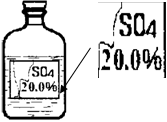
【提出猜想】 提示:这瓶无色溶液只能是下列四种溶液中的一种:①硫酸镁溶液、②硫酸钠溶液、③硫酸溶液、④硫酸铵溶液
【查阅资料】
A:常温下,相关物质的溶解度如下:
| 物质 |
MgSO4 |
Na2SO4 |
H2SO4 |
(NH4)2SO4 |
| 溶解度 |
35.1g |
19.5g |
与水任意比互溶 |
75.4g |
B:MgSO4、(NH4)2SO4的水溶液显酸性
请回答:该无色溶液一定含有的离子是;
【实验探究】(药品可自选)通过查阅资料(相关物质的溶解度表),小明同学认为猜想(填序号)不成立,原因是 ;
为确定其它几种猜想是否正确,小明同学设计实验继续进行探究:
| 实验操作 |
实验现象 |
实验结论 |
| 取该溶液少许于试管中,向其中滴加 几滴溶液 |
溶液中有白色沉淀生成 |
猜想(填序号)成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟比色卡对照 |
溶液pH小于7 |
猜想③成立 |
小雅同学认为小明实验操作②的结论不正确,她的理由是,
请你写出实验操作①反应的化学方程式。
漂白液是家庭常用的洗涤剂。化学兴趣小组的小明同学在家发现半瓶敞口放置的漂白液,对漂白液的漂白原理和该漂白液是否失效产生了疑问。他将该漂白液带到学校,在老师的指导下,与小组同学一起进行了探究。
【查阅资料】
①漂白液的制取原理:Cl2+2NaOH =NaClO+NaCl+H2O,其有效成分是NaClO。
②漂白液的漂白原理:NaClO在空气中发生反应:2NaClO+H2O+CO2 =Na2CO3+2HClO。
生成的HClO能使有色布条(含有机色素)褪色。
③ HClO不稳定,易分解,分解后丧失漂白作用。
④碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应,写出该反应的化学方程式 。
【提出问题1】该漂白液是否失效?
【实验探究1】请将下述实验报告填写完整。
| 实验操作 |
实验现象 |
实验结论 |
| 该漂白液已完全失效 |
【提出问题2】该漂白液的主要成分是什么?
【提出猜想】该漂白液的主要成分可能是:
① NaCl ②③ NaCl、Na2CO3、NaOH
【实验探究2】
| 实验操作及实验现象 |
实验结论 |
| 取少量该漂白液于试管中,加入过量的稀盐酸。观察到 |
猜想①不合理 |
| 猜想③不合理,②合理 |
,
【实验反思】漂白液开瓶后要尽快使用,每次使用后要拧紧瓶盖。
探究化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题。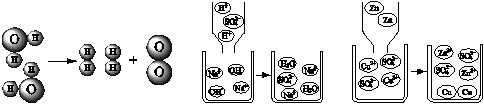
A B C
(1)图A表示的是电解水反应的微观示意图。写出反应的化学方程式;在该反应中水分子、氢分子、氧分子的个数比为。
(2)物质之所以发生化学反应,从微观的角度看,是因为反应物的微粒之间在一定条件下发生有效的相互作用,使微粒的结构发生改变,或微粒重新排列组合。①从微粒的角度说明图B反应的实质是。②图C所示反应中,发生有效的相互作用而促使反应发生的微粒是(写出微粒的符 号)。
(3)在点燃条件下,A和B反应生成C和D。反应前后分子变化的微观示意图如下所示。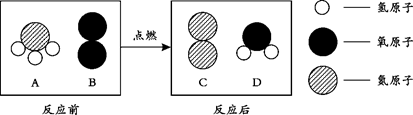
下列说法正确的是(填数字序号)。
①该反应类型为复分解反应
② 4种物质中属于氧化物的是D
③反应前后,元素化合价均未发生变化
④若48gB完全反应,则生成C的质量为28g
某校化学课外活动小组欲将含可溶性杂质和少量泥沙的CaCl2固体进行提纯,得到纯净的CaCl2固体。欲除去泥沙,得到较为纯净的CaCl2固体,应采取的实验步骤是:
①;②;③ 蒸发。上述三步操作都要用到的玻璃仪器是:。(填仪器名称)
经实验证实所含可溶性杂质为NaCl,现欲去除该杂质,将进行下列操作。

根据以上流程图,回答下列问题:
①请写出A、B、C三种物质的化学式:A___________;B___________;C___________
②写出加入过量试剂A的目的是______________________________________________
③写出加入过量试剂A的化学反应方程式:
___________________________________________________________________________
④实验中称得滤渣的B的质量为5g,试计算蒸发后得到纯净CaCl2的质量是 _______ g。(精确到0.1 g)